لدراسة سرعة تشكيل شاردة المغنيزيوم
عند اللحظة
1 / أ ) حدّد الثنائيتين
مع كتابة المعادلتين النصفيتين .
ب ) هل التفاعل الحادث ستيكيومتري ؟
ﺠ ) أنجز جدول تقدم التفاعل ، وأستنتج المتفاعل المحدّ .
د ) استنتج تركيز شاردة
2 / بمتابعة تطور تركيز شاردة
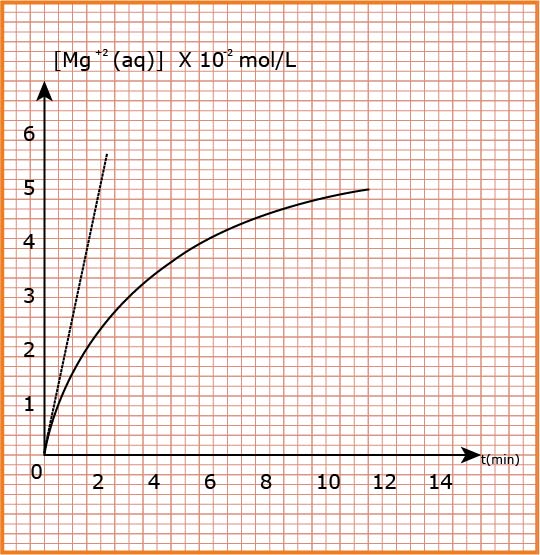
أ - هل ينتهي التفاعل عند
ب – عرّف زمن نصف التفاعل وأحسب قيمته .
ﺠ - أحسب التركيب المولي للوسط التفاعلي عند اللحظة
د - اعتمادا على البيان استنتج السرعة الحجمية لتشكل
هـ – إذا وضعنا في البداية
يعطى :
1-أ) الثنائيتان
الأكسدة :
الإرجاع :
ب ) كميات المادة الابتدائية :
حتى يكون المزيج سيتكيومتريا في هذا التفاعل:
ﺠ) جدول تقدم التفاعل
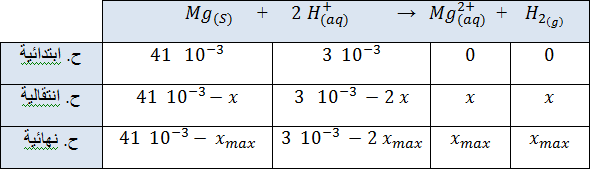
المتفاعل المحدّ :
المتفاعل المحد هو شوارد الهيدرونيوم
د ) من جدول التقدم نجد :
عند نهاية التفاعل
2- أ) من البيان عند
إذن انتهي التفاعل عند
ب ) زمن نصف التفاعل
من البيان نجد
عند اللحظة
ومنه
لدينا
التركيب المولي للمزيج :
د ) السرعة الحجمية عند
ﻫ - العامل الحركي :
العامل الحركي الذي أثر على سرعة التفاعل هو زيادة كمية أحد المتفاعلات ( وفي هذه الحالة تمّ زيادة كمية شوارد الهيدرونيوم فازدادت قيمة السرعة ) .








