- نضع في بيشر حجما قدره
1-1) اكتب معادلة التفاعل المنمذج للتحول الكيميائي ، إذاعلمت أن الثنائيات
2-1) أنجز جدول تقدم التفاعل .
2) المتابعة الزمنية لهذا التحول الكيميائي سمحت لنا برسم تغيرات كمية المادة لشوارد
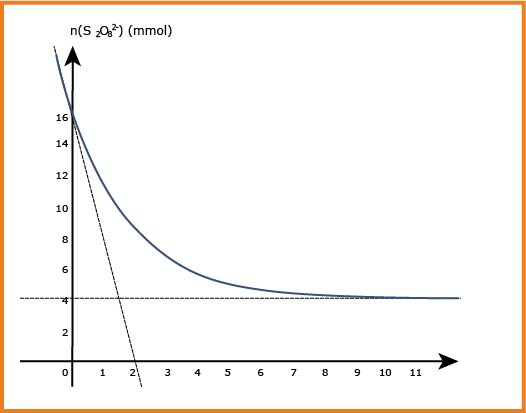
1-2) احسب التركيز المولي للمحلولين
2-2) باعتبار التفاعل تام ، أوجد التقدم الأعظمي للتفاعل
3-2) احسب تراكيز الأفراد الكيميائية الموجودة في المزيج عند اللحظة
4-2) احسب السرعة الحجمية للتفاعل
5-2) استنتج سرعة تشكل ثنائي اليود عند نفس اللحظة .
3) نكرر إجراء التفاعل السابق ، ونستعمل محلولا لبيروكسوديكبريتات البوتاسيوم حجمه
هل تتغير المقادير التالية أم لا مع التعليل:
أ) التقدم الأعظمي
ب) السرعة الحجمية عند اللحظة
جـ)زمن نصف التفاعل .
-1) معادلة التفاعل:
2-1) جدول تقدم التفاعل:
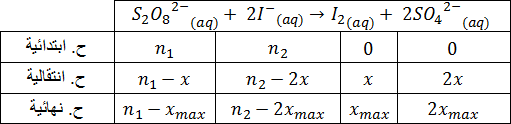
1-2) حساب
من خلال المنحنى نجد عند اللحظة
2-2) إيجاد التقدم الأعظمي
بماأن التفاعل تام ، ولدينا حسب البيان
3-2) حساب تراكيز الأفراد الكيميائية عند اللحظة
لدينا عند اللحظة
وبالتالي نجد :
بالتعويض نجد :
4-2) حساب السرعة الحجمية
لدينا:
بعد اشتقاق العبارة نجد :
حيث
بعد الحساب نجد قيمة السرعة الحجمية :
5-2) استنتاج سرعة تشكل ثنائي اليود:
بعد الحساب نجد :
3) تحديد المقادير التي تتغير والتي لاتتغير :
أ) لدينا
ب) هناك زيادة في أحد تراكيز المتفاعلات ( عامل حركي ) وبالتالي السرعة تتغير .
جـ) نفس الملاحظة بماأن السرعة تتغير فإن زمن نصف التفاعل








