نقترح دراسة حركية تحول كيميائي بطيء لتحليل الماء الأكسيجيني بواسطة شوارد اليود بوجود حمض الكبريت، نعتبر التحول تاما. معادلة التفاعل المنمذج للتحول المدروس تكتب:
إن محلول ثنائي اليود المتشكل ملوّن.
1/ الدراسة النظرية للتفاعل:
أ)عرّف المؤكسِد والمرجِع.
ب)ما هما الثنائيتان
2/ متابعة التحول الكيميائي:
في اللحظة
مكّنت طريقة تجريبية معينة، من قياس التركيز

أ)هل المزيج الابتدائي في نسبة ستيكيومترية؟
ب)أنجز جدول التقدم للتفاعل الكيميائي.
ج) أوجد العلاقة بين
د) عيّن التّقدم ألأعظمي ثمّ استنتج القيمة النّظرية لتركيز ثنائي اليود المتشكل عند نهاية التفاعل.
3/ يمثّل البيان(الشكل
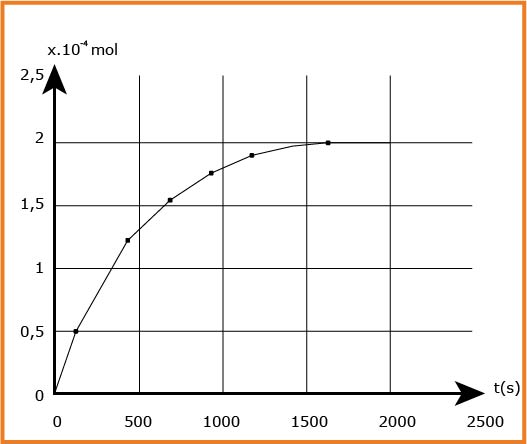
أ/ ما تركيب المزيج المتفاعل عند اللحظة
ب/ كيف تتغير السرعة الحجمية للتفاعل؟ علّل. ما هو العامل الحركي المسؤول عن هذا التّغيّر؟
ج/ أعط تعريف زمن نصف التفاعل ثم عيّنه.
1/-أ- المؤكسد : هو كل فرد كيميائي يمكنه إكتساب إلكترون أو أكثر
المرجع : هو كل فرد كيميائي يمكنه تحرير إلكترون أو أكثر
ب – الثنائيتان مؤكسد – مرجع المشتركتين في التفاعل هما :
2 / - أ – ستكيومترية المزيج الإبتدائي : الكميتان الإبتدائيتان هما :
بما أن :
إذن المزيج الإبتدائي لا يحقق نسبة ستكيومترية
ب – جدول التقدم :
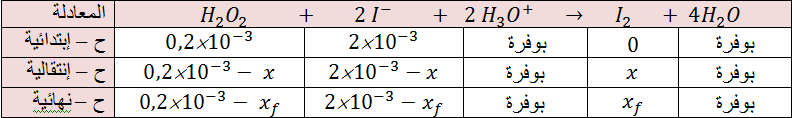
جـ - إيجاد العلاقة بين
لدينا من قانون التركيز المولي :
و من جدول التقدم نلاحظ أن
وحجم المزيج الكلي هو :
د – تعيين التقدم الأعظمي : بما أن التفاعل تام فإن
من أجل
و من أجل
نأخذ أصغر قيمة إذن :
إستنتاج القيمة النظرية لتركيز ثنائي اليود
3 / - أ - التركيب المولي للمزيج عند اللحظة
الأفراد الكيميائية المتواجدة في المزيج هي
الأفراد
من البيان نجد قيمة
و عليه فإن
بالإسقاط على البيان نجد :
من جدول التقدم نحسب الكميات التالية :
ب – كيفية تغير السرعة الحجمية للتفاعل :
عبارة السرعة الحجمية هي :
حيث
نلاحظ أن قيمة المبل تتناقص مع الزمن إذن السرعة الحجمية للتفاعل تتناقص مع تزايد الزمن .
العامل الحركي المسؤول عن هذا التناقص هو تناقص التراكيز المولية للمتفاعلين
جـ - تعريف زمن نصف التفاعل : هو الزمن اللازم لبلوغ التفاعل نصف تقدمه النهائي .
تعيين قيمة
بما أن :
فإن :
بالإسقاط على البيان نجد :








