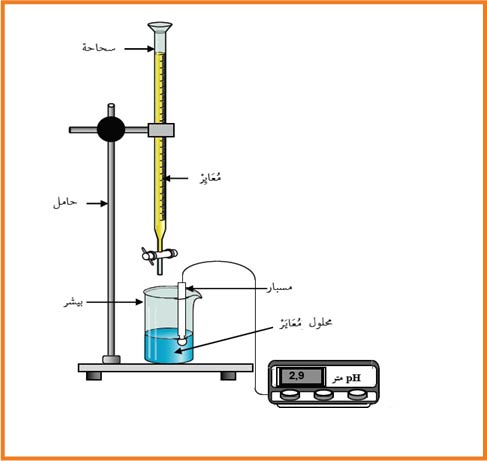
معايرة محلول النشادر بمحلول حمض كلور الماء.نضع في بيشر
1- أرسم التجربة.
2- أكتب معادلة التفاعل.
إن حمض كلور الهيدروجين يعطي شوارد
معادلة التفاعل هي مجموع المعادلتين:
3- أحسب الثابت
نعطي في
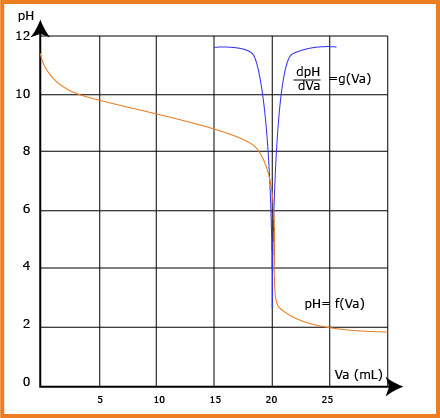
4- عين من المنحنى حجم الحمض المضاف عند التكافؤ.
استنتج تركيز
في هذه الحالة نقرأ من المنحنى. عند التكافؤ:
عند التكافؤ إن المتفاعلات تدخل بالنسب الستكيومترية لتفاعل المعايرة، فكلاهما يتفاعل كليا.
ملاحظة:
نستطيع أن نجد نفس النتيجة من خلال جدول التقدم للتفاعل عند التكافؤ.
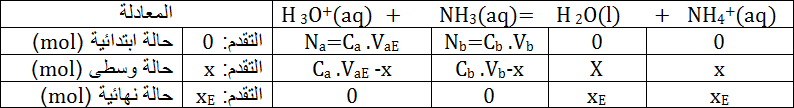
نلاحظ أن :
و
يعني:
5- اشرح لماذا الـ
إن المعادلة
6- ما هو الكاشف الملون المناسب المستعمل.يعطى
مجالات التغير اللوني للكواشف الملونة:
- الفينول فتالين:
- الهيليانتين:
- أحمر الميثيل:
الكاشف المناسب هو أحمر الميثيل حيث








