التمرين الأول :
لدراسة تطورالتحول الكيميائي بين شوارد محلول
لهذا الغرض نمزج عند اللحظة
1- اكتب المعادلتين النصفيتين ثم معادلة التفاعل الحادث .علما أن الثنائيتين المشاركتين في التفاعل هما :
2- حدد التقدم ألأعظمي للتفاعل والمتفاعل المحّد علما أن التفاعل تام .
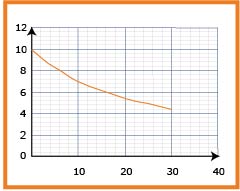
3- بالاعتماد على البيان احسب التركيز
4- انشىء جدولا لتقدم التفاعل .
5- عرِّف زمن نصف التفاعل واستنتج قيمته بيانيا .
6- احسب سرعة التفاعل عند اللحظة
التمرين الثاني :
البولونيوم
1- أعط تركيب نواة البولونيوم
2- أكتب معادلة تفكك نواة
3- عرّف زمن نصف العمر
4- أكتب قانون التناقص الإشعاعي
5- أكتب العلاقة بين ثابت التفكك وزمن نصف العمر ثمّ احسب قيمة ثابت التفكك بوحدة s-1 للبولونيوم
6- احسب
7- برّر، بالحساب، العبارة " غرام واحد فقط منه يقدم نشاطاً إشعاعياً يقدّر بـ
8- البولونيوم
هذه التفككات هي من نوع
- حدّد
9- يشكل البولونيوم رفقة البيريلوم
احسب الطاقة المحرّرة من هذا التفاعل بوحدة الجول
معطيات:
- بعض العناصر الكيميائية:
- كتل الأنوية:
- الكتلة المولية الذرية:
- عدد أفوغادرو:
- سرعة الضوء في الفراغ:
- وحدة الكتل الذرية:
التمرين الثالث :
نحقق التركيب المعطى في الشكل
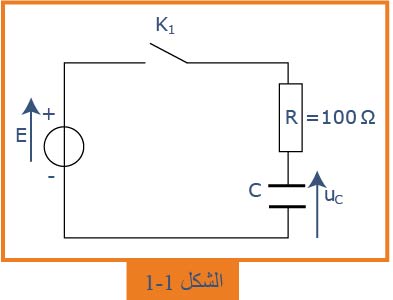
. نغلق القاطعة
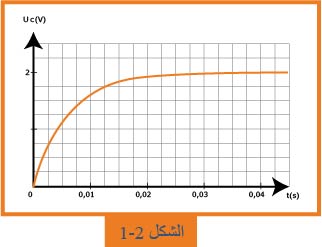
1.1- بين كيفية ربط راسم الاهتزاز المهبطي للحصول على هذا المنحنى.ما هي الظاهرة المشاهدة؟
2.1- بتطبيق قانون جمع التوترات، أوجد المعادلة التفاضلية بدلالة التوتر
3.1- تحقق أن حل المعادلة التفاضلية هو:
4.1- اعتماداً على المنحنى، حدّد قيمة
5.1- عيّن قيمة
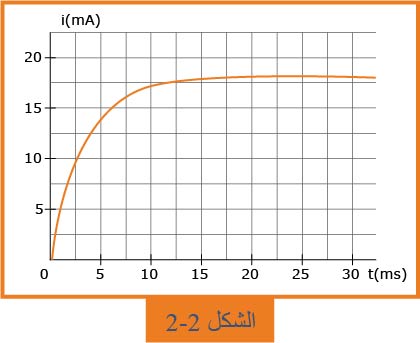
2- نعوّض المكثفة بوشيعة ذاتيتها
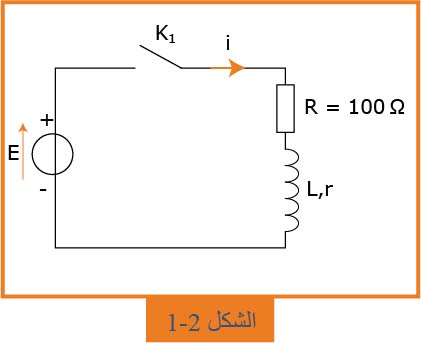
قانون جمع التوترات المطبق على هذه الدارة أعطى المعادلة النفاضلية التالية:
1.2- ما هي الظاهرة التي يبرزها منحنى الشكل
2.2- أوجد عبارة شدة التيار الكهربائي
3.2- عيّن، بيانياً، قيمة
4.2- ثابت الزمن لثنائي القطب
5.2- عيّن، بيانياً، قيمة
.
التمرين الرابع :
حمض البنزويك
المعطيات:
- الكتلة المولية الجزيئية:
- الناقليات المولية الشاردية:
I.دراسة تفاعل حمض البنزويك مع الماء:
نحضر محلولا مائيا
1- أنشئ جدول لتقدم التفاعل المنمذج للتحول الحادث بين حمض البنزويك و الماء.
2- أعطي عبارة
- بين أن
3- أحسب نسبة التقدم النهائي للتفاعل. ماذا يمكن قوله عن حمض البنزويك؟
.-4بين أن عبارة كسر التفاعل عند التوازن هي:
-5استنتج ثابتي الحموضة
II. معايرة حمض البنزويك في مشروب غازي:
تشير لصيقة قارورة مشروب غازي حجمها
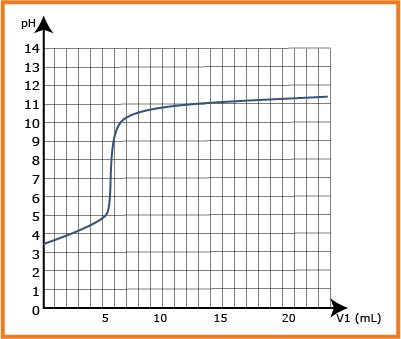
1- أكتب معادلة التفاعل المنمذج للتحول الحادث.
2- أحسب ثابت التوازن
3- عرف نقطة التكافؤ ثم حدد احداثياتيها.
4- استنتج التركيز المولي
5- هل القيمة المشار إليها في اللصيقة صحيحة؟
6- ما هي الصفة الغالبة للثنائية
الصود؟ علل.
التمرين الخامس
دور قمر اصطناعي

نعتبر القمر الاصطناعي
1.في أي مرجع تتم دراسة حركة هذا القمر الاصطناعي؟
2.أعط العبارة الشعاعية للقوة المطبقة من طرف الأرض على
3.ما هي الفرضية المتعلقة بمرجع الدراسة والتي تسمح بتطبيق القانون الثاني
4.يقول القانون الثاني لنيوتنبين أن عبارة تسارع حركة مركز هذا القمر الاصطناعي تعطى بالعبارة التالية:
- مثل شعاع تسارع حركة مركز عطالة القمر بصورة كيفية على الرسم السابق .
- ما هي خصائص شعاع التسارع في حالة الحركة الدائرية المنتظمة؟ بين أن هذه الخواص محّققة هنا.
5.أعط عبارة سرعة مركز عطالة القمر الاصطناعي بدلالة المقادير التالية
6.عبر عن الدور
7.أحسب كتلة الأرض.
التمرين السادس
يعتبر حمض الميثانويك من الأدوية الناجعة لمحاربة بعض الطفيليات التي تهاجم النحل المنتج للعسل.
يهدف هذا التمرين إلى دراسة تفاعل حمض الميثانويك مع الماء و مع محلول هيدروكسيد الصوديوم .
معطيات:
تمت جميع القياسات عند درجة الحرارة
الجداء الشاردي للماء
يعطي الجدول التالي بعض الكواشف الملونة و مناطق انعطافها.

1.تفاعل حمض الميثانويك مع الماء
نعتبر محلولا مائيا
ننمذج التحول الكيميائي الذي يحدث بين حمض الميثانويك و الماء بالمعادلة الكيميائية التالية:
1.1.أنجز جدول تقدم التفاعل
2.1. بين أن نسبة التقدم النهائي
3.1. أكتب عبارة كسر التفاعل
.4.1حدد قيمة الثابت
2.تفاعل حمض الميثانويك مع محلول هيدروكسيد الصوديوم
نستعمل التركيب التجريبي المبين في الشكل لمعايرة الحجم
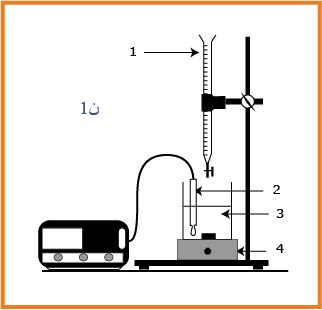
.1.2أعط أسماء العناصرالموافقة للأرقام
.2.2 يأخذ
3.2. أوجد الحجم
.4.2 حدد، معللا جوابك، من بين الكواشف الملونة المبينة في الجدول أعلاه الكاشف المناسب لهذه المعايرة.
التمرين الأول
1-المعادلة النصفية للإرجاع :
المعادلة النصفية للاكسدة
المعادلة أكسدة إرجاع
2-
المتفاعل المحّد هو :
3-حساب التركيز المولي
4-انشاء جدول تقدم التفاعل :

5-تعريف زمن نصف التقدم :
الزمن اللازم لبلوغ تقدم التفاعل نصف قيمة التقدم الأعظمى .
بيانيا :
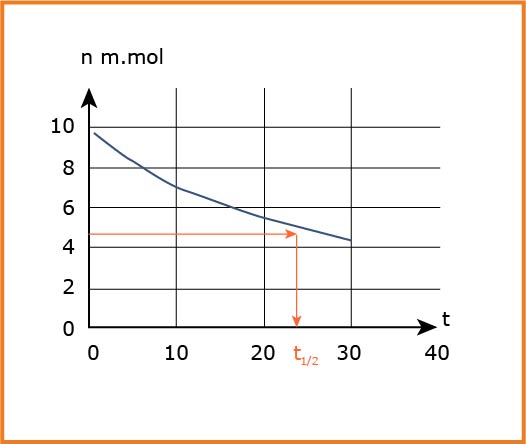
6-حساب سرعة التفاعل عند اللحظة
نعلم أن عبارة سرعة التفاعل :
نشتق العبارة التالية
و لدينا :
التمرين الثاني
1- تركيب نواة البولونيوم
- عدد البروتونات
- عدد النيترونات:
2- معادلة تفكك نواة
ومنه:
إذن:
3- زمن نصف العمر
4- قانون التناقص الإشعاعي:
حيث:
- : عدد الأنوية في العينة في اللحظة
- : عدد الأنوية الابتدائية في العينة
- : ثابت التفكك
5-
6-
7- حساب نشاط عينة كتلتها :
$$$$A=\lambda N=166000 \times 10^9 Bq
وهو تبرير العبارة " غرام واحد فقط منه يقدم نشاطاً إشعاعياً يقدّر بـ
8-
حسب قوانين الانحفاظ:
ومنه:
ومنه:
9- يشكل البولونيوم رفقة البيريلوم
التمرين الثالث
1.1 يوصل بين طرفي المقاومة لأن تطور شدة التيار من تطور توتر المقاومة
الظاهرة المشاهدة: شحن مكثفة
2.1 من قانون جمع التوترات:
ولدينا :
ومنه :
3.1 بالتعويض في المعادلة التفاضلية:
الحلّ محقّق حيث
4.1
وعند انتهاء شحن المكثفة
5.1
بالاسقاط نجد:
- استنتاج
1.2- الظاهرة التي يبرزها المنحنى هي تأخر نشوء التيار في الدارة، والعنصر المسبب لهذه الظاهرة هو الوشيعة.
2.2- في النظام الدائم
أي
وتصبح المعادلة التفاضلية:
ومنه:
3.2- من البيان نجد:
استنتاج
ومنه
4.2- لدينا:
ومنه:
ولدينا:
ومنه:
5.2- تعيين
بالاسقاط نجد:
استنتاج
التمرين الرابع
I
1.الكمية الابتدائية للحمض :
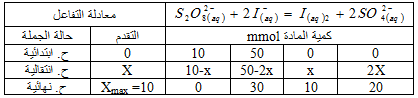
2.بين أن
3.
4.
5.
II
1.
2.
نستنتج أن تفاعل المعايرة تام .
3. نقطة التكافؤ : عندما يتساوى عدد المولات الأساسية و الحمض المتفاعل
- إحداثيات نقطة التكافؤ :
بطريقة المماسات
4.
5.
- إن القيمة التي تشير إليها اللصيقة صحيحة .
6. عند إضافة حجم
التمرين الخامس
1. تتم دراسة حركة هذا القمر الاصطناعي في المرجع الجيو مركزي
2.العبارة الشعاعية للقوة المطبقة
3.لتطبيق القانون الثاني لنيوتن يجب أن يكون المرجع عطاليا(غاليليا).
4.عبارة تسارع القمر الاصطناعي
حيث
خصائص شعاع التسارع لجسم نقطي
- حركة دائرية منتظمة
- نصف قطر مساره
- سرعته
- الحامل: قطر المسار
- الاتجاه نحو مركز المسار
- طويلته
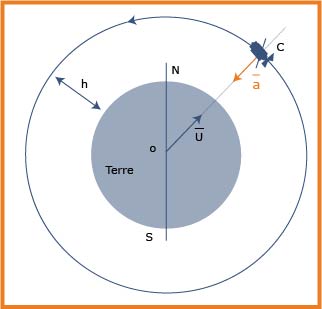
5.عبارة سرعة مركز عطالة القمر الاصطناعي
القمر الاصطناعي يقطع مسافة
6.عبارة الدور
-استنتج القانون الثالث لكبلر المطبق على هذه الحركة الدائرية
7. كتلة الأرض
التمرين السادس
1- دراسة محلول حمض الميثانويكمع الماء:
1.1-جدول التقدم:
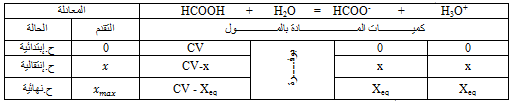
2.1-
و منه
بما أن
3.1-
4.1-
2- تفاعل حمض الميثانويك مع محلول هيدروكسيد الصوديوم
1.2-
- : سحاحة
- :مصبار
- : محرك
- : محلول المعاير(حمض الميثانويك)
2.2-
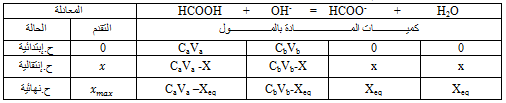
3.2- عند التكافؤ
4.2 – الكاشف الملون المناسب هو: الفينول فيتالين لأن








