التمرين 01:
1- نذيب حمض الميثانويك
قياس ال
1-1 - أكتب معادلة التفاعل الكيميائي الحادث.
2-1- انشأ جدول التقدم واستنتج المتفاعل المحد.
3-1- احسب التقدم النهائي
4-1- استنتج نسبة التقدم النهائي
2- نمزج حجم
قياس
1-2- كيف تغير
2-2- اكتب معادلة التفاعل حمض – اساس الحادث.
3-2- انشأ جدول تقدم التفاعل بدلالة التقدم
4-2- عين التقدم الأعظمي و نسبة التقدم النهائي . ماذا تستنتج ؟
التمرين 02:
1-لدينا محلولا
أ- أكتب معادلة تفاعل حمص الفلور مع الماء
ب- أنشئ جدول تقدم التفاعل .
ج- أكتب عبارة النسبة النهائية للتقدم
د- أكتب عبارة كسر التفاعل في الحالة النهائية بدلالة
2- أكتب عبارة الناقلية النوعية للمحلول
3- أعطى قياس الناقلية النوعية للمحلول عند التوازن القيمة
-أحسب كل من
4- قياس الناقلية النوعية لمحلول
أ- احسب كل من
ب- إستنتج تأثير تركيز المحلول على كل من النسبة النهائية لتقدم التفاعل و الكسر النهائي للتفاعل.
يعطى :
التمرين الأول:
1-1-معادلة التفاعل بين حمض الميثانويك و الماء:
1-2- جدول تقدم التفاعل :
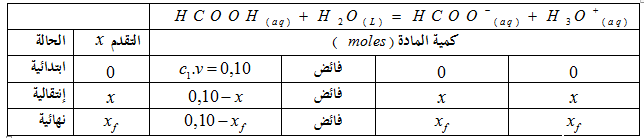
يتواجد الماء في المحلول الحمضي بكميةة فائضة: فان المتفاعل المحد هو حمض الميثانويك.
1 -3- حساب التقدم النهائي : حسب الحالة النهائية للجملة الكيميائية :
حساب التقدة الأعظمي : من جدول التقدم :
4-1 نسبة التقدم النهائي :
فالتحول الكيميائي ليس تاما.
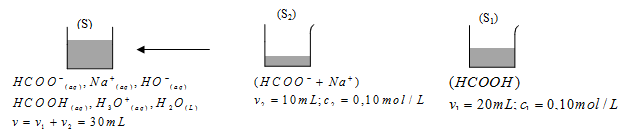
1-2- ان الــــــ
2-2- معادلة التفاعل حمض – أساس الحادث في المزيج :
2-3- جدول تقدم التفاعل :
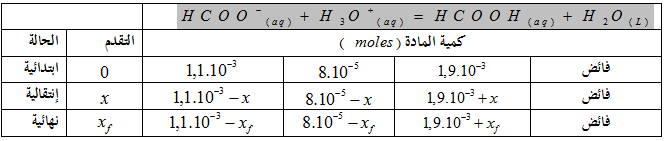
منه :
أ) -
ب)-
منه :
4-2- حساب التقدم الأعظمي :
مع :
فان المتفاعل المحد هو شاردة الأوكسونيوم
نسبة التقدم النهائي : في الحالة النهائية للمزيج :
و
بالمطابقة :
فان :
التمرين الثاني :
1.أ.كتابة معادلة تفاعل حمص الفلور مع الماء
ب .جدول تقدم التفاعل
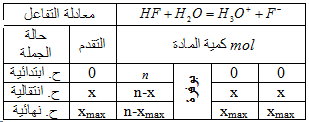
ج.أكتب عبارة النسبة النهائية للتقدم
د. عبارة كسر التفاعل في الحالة النهائية بدلالة
2.
3.أحسب كل من
4.احسب كل من
عند التوازن لجملة كيميائية








