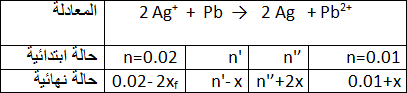التمرين الأول
يتفاعل محلول حمض كلور الهيدروجين مع الزنك وفق المعادلة التالية :
في اللحضة

1- حدد الثنائتين الداخلتين في التفاعل
2 - عبر عن كمية المادة لـغاز ثنائي الهيدروجين
3 - أحسب كميات المادة الإبتدائية للمتفاعلات .
4 - أنجز جدول التقدم التفاعل و أستننتج العلاقة بين التقدم
5 - أرسم المنحنى البياني
6 - ما هي قيمة السرعة الحجمية للتفاعل في اللحظات
تعطــــى :
التمرين الثاني
المنبه القلبي
1- ا- ماذا تعني العبارات : نظير البلوتونيوم
ب- ما هو العدد الذي يميز نواة الذرة ؟
جـ - في نظرك كيف تنتج الطاقة من المادة المشعة كي تضمن اشتغال الجهاز؟
2- ا- اكتب معادلة تفكك البلوتونيوم مع توضيح قوانين الانحفاظ المستعملة .
ب- احسب الطاقة المحررة من تفكك نواة من المادة المشعة .
3- يعطى المنحنى البياني للتناقص الاشعاعي
باعتبار بداية الزمن
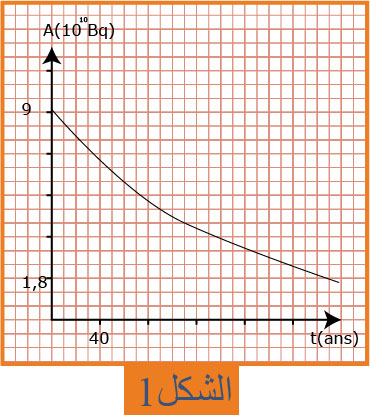
ا- احسب النشاط الابتدائي
ب- احسب ثابت التفكك
جـ - احسب قيمة الكتلة
4- عمليا الجهاز يعمل بشكل جيد إلى أن يتناقص نشاط العينة بـ
5- المريض الذي زرع له هذا الجهاز وهو في الخمسين من عمره متى يضطر لاستبداله ؟
التمرين الثالث
قصد شحن مكثفة مُفرغة سعتها
- مولّد كهربائي ذوا توتر ثابت مقاومته الداخلية مهملة
- ناقل أومي مقاومته
- قاطعة
في اللحظة
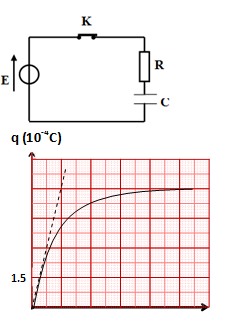
1-أوجد المعادلة التفاضلية التي تٌحققها شحنة المكثفة وبيّن أنها تُكتب على الشكل التالي:
2-استخرج بيانيا قيم كل من
3-أوجد سعة المكثفة
4- نُكرّر التجربة السابقة بتغيير المقادير المميّزة للدارة كما هوموضّح في الجدول فتحصلنا على المنحنيات الموّضحة في الشكل
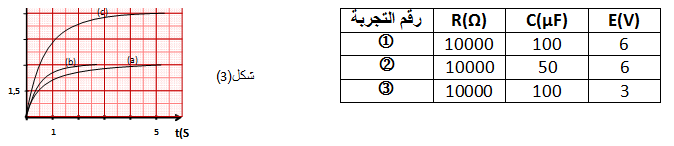
أنسب لكل منحنى التجربة الموافقة له مع التعليل؟
التمرين الرابع
نُذيب كتلة
1-أعط البروتوكول التجريبي لتفاعل المعايرة مستعينا برسم.
2-أكتب معادلة تفاعل المعايرة الحادث
3-أثبت صحة العلاقة :
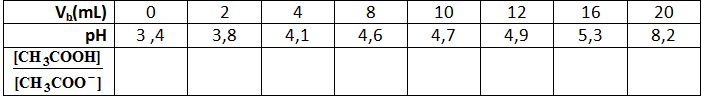
4-أكمل الجدول ثم أرسم المنحنى البياني
5-استخرج من البيان الحجم المُضاف عند نقطة نصف التكافؤ ثم استنتج التركيز المولي لمحلول حمض الإيثانويك ،وكذا قيمة الكتلة
6- ماهي الصفة الغالبة للثنائية
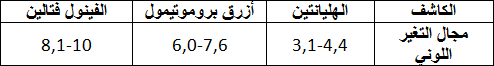
7-ما هو الكاشف الملون المناسب لهذه المعايرة من بين الكواشف الآتية:
التمرين الخامس
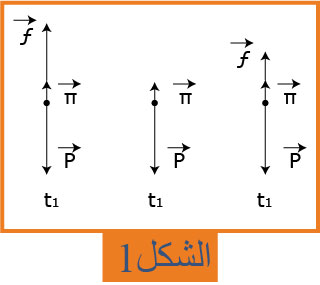
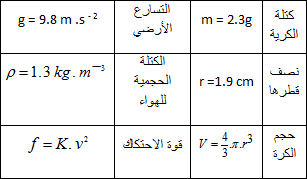
1- يعطى التمثيل الشعاعي للقوى المطبقة على الكرية أثناء حركة سقوطها في الهواء. رتب هذه الأشكال حسب التزايد الزمني اثناء الحركة . علل .( شكل
2- قارن بين قيمة كل من قوة الثقل ودافعة ارخميد س . ماذا تستنتج .
3- بتطبيق القانون الثاني لنيوتن اكتب المعادلة التفاضلية التي تحققها سرعة الكريه .
4- ان المتابعة الزمنية لحركة الكرية مكنت من رسم بياني السرعة والتسارع . انسب كل منحني بياني لمقداره الموافق علل.( شكل
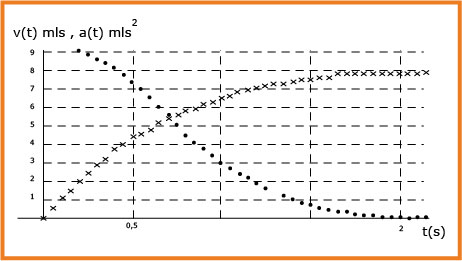
5- حدد بيانيا :
أ - قيمة السرعة الحدية
ب - القيمة التجريبية للثابت
جـ- قيمة تسارع الحركة عند اللحظة
د- قيمة الزمن المميز للسقوط
6- في حالة كرة نصف قطرها
احسب
7- اثبت ان العبارة التجريبية للسرعة اللحظية للكرية تعطى بدلالة تسارع الحركة بالعلاقة التالية :
المعطيات
التمرين السادس
ننجز عمودا باستعمال كأسين ، يحتوي الاول على صفيحة الرصاص
يشير جهاز الفولط عند تركيبه بين طرفي العمود أن القطب الموجب هو سلك الفضة .حجم كل من المحلولين هو
نعطي قيمة ثابت التوازن للتفاعل داخل العمود
1. أكتب نصفي معادلة التفاعل الذي يحدث على مستوى كل مسرى . و استنتج المعادلة الاجمالية لتفاعل الاكسدة و الارجاع .
2. أحسب كسر التفاعل الابتدائي
3.نوصل بين طرفي العمود ناقل اومي و نقيس شدة التيار الذي يمر قيه خلال
أحسب كمية الكهرباء التي يمررها هذا المولد عبر الناقل الاومي خلال هذه المدة .
4.أنشأ جدولا لتقدم التفاعل ، حدد تراكيز الانواع الكيميائية خلال ساعة من الاشتغال .
يعطى :
التمرين الأول
1- الثنائيتين الداخلتين في التفاعل ( (ox/red :
المعادلتين النصفيتين :
م ن أكسدة :
م ن إرجاع :
2- التعبير عن كمية المادة لغاز ثنائي الهيدروجين
3 – كميات المادة الإبتدائية :
4 – جدول التقدم التفاعل:
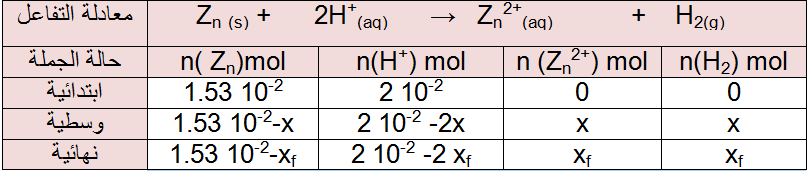
العلاقة بين التقدم x و
5 – رسم المنحنى البياني .( باستعمل مقياس الرسم
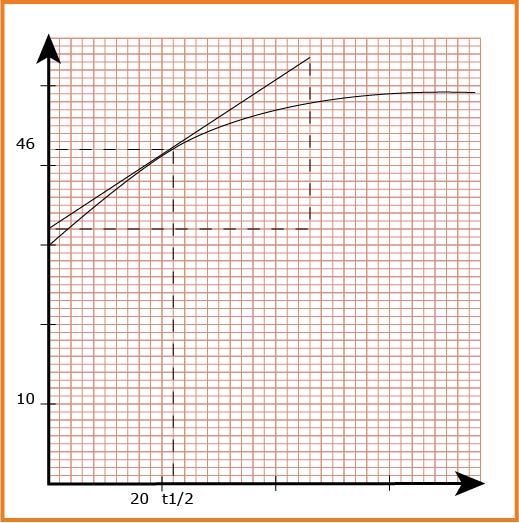
6 - قيمة السرعة الحجمية للتفاعل في اللحظات :
نلاحظ أن السرعة الحجمية للتفاعل تناقصت وذلك لتناقص تركيز المتفاعلات
لدين من جدول التقدم :
أو
هذا يعني أن
إذا المتفاعل المحد هو شوارد
زمن نصف التفاعل : هو الزمن الموافق لـ :
و من المنحنى نجده حوالي :
التمرين الثاني
1-1- نظير البلوتونيوم : هي نواة لها نفس العدد الذري
- مادة مشعة : هي انوية غير مستقرة تتفكك تلقائيا .
- الإشعاع
2-1- النواة يميزها العدد الذري
3-1- عندما تتفكك النواة جزء من طاقة تماسكها يأخذه الجهاز بآلية مناسبة لتشغيل الجهاز .
1-2- معادلة التفكك :
علما أن قوانين الانحفاظ :
2-2- الطاقة المحررة :
1-3- حساب
2-3- حساب
- حساب
3-3- حساب
6- حساب عدد الانوية المتبقية :
7- موعد استبدال الجهاز :
بيانيا
و منه
يستبدل الجهاز عندما يصبح عمره في حدود :
التمرين الثالث
1- بتطبيق قانون جمع التوترات :
2- بالمقارنة نجد أن :
و
عند النظام الدائم :
وهي تمثل الشحنة الأعظمية للمكثفة.
وهي تمثل ثابت الزمن للدارة .
3-
4- المنحنى
المنحنى
المنحنى
التمرين الرابع
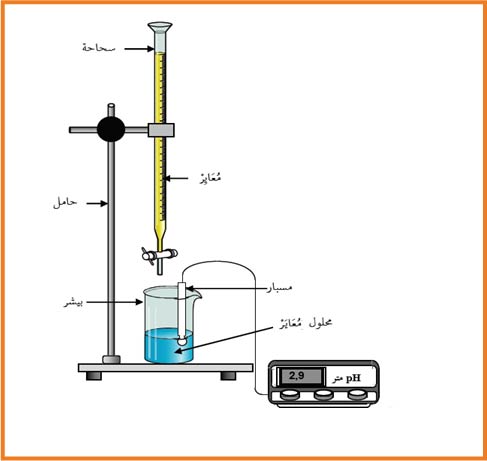
1- أعط البروتوكول التجريبي لتفاعل المعايرة مستعينا برسم.
بواسطة الماصة ناخذ حجم معين من الحمض(المعايَر) ونضعه فى بيشر الذى يوضع على المخلاط و نضيف قطرات من كاشف
ـ نضع المحلول هيدركسيد الصوديوم (المعايٍر) الاخر فى السحاحة ونضبط بدايةالقياس
ـ نبدا فى التسحيح قطرة تلو الأخرى حتى تغير اللون الذي يوافق نقطة التكافؤ
2-أكتب معادلة تفاعل المعايرة الحادث
3-أثبت صحة العلاقة :
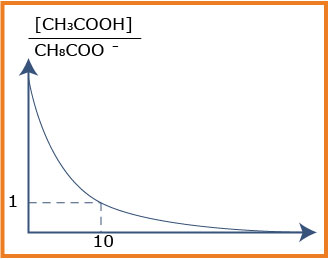
4-أكمل الجدول ثم أرسم المنحنى البياني
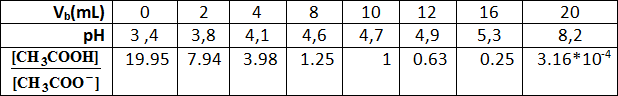
5-استخرج من البيان الحجم المُضاف عند نقطة نصف التكافؤ ثم استنتج التركيز المولي لمحلول حمض الإيثانويك ،وكذا قيمة الكتلة
6- ماهي الصفة الغالبة للثنائية
عند إضافة حجم
عند سكب
7-ما هو الكاشف الملون المناسب لهذه المعايرة من بين الكواشف الآتية:
عند التكافؤ الحجم المسكوب هو
التمرين الخامس
1- ترتيب الأشكال حسب التزايد الزمني اثناء الحركة :
قوة الاحتكاك معدومة عند :
قبل بداية الحركة والسرعة معدومة:
2- المقارنة :
- يمكن إهمال دافعة ارخميدس أمام شدة قوة الثقل .
3- المعادلة التفاضلية التي تحققها سرعة الكرية .
4- البيان
- البيان
1-5- السرعة الحدية :
2-5- القيمة التجريبية لـ
3-5- قيمة
4-5- قيمة الزمن
6- حساب
- نلاحظ أن
6- إثبات العبارة : لدينا :
التمرين السادس
1- أكتب نصفي معادلة التفاعل الذي يحدث على مستوى كل مسرى . و استنتج المعادلة الاجمالية لتفاعل الاكسدة و الارجاع .
أكسدة
إرجاع
2- كسر التفاعل الابتدائي:
3-
4- جدول التقدم