لدراسة تفاعل كيميائي في وسط حمضي و عند درجة حرارة ثابتة بين الشاردة فوق منغنات
عند
تعطى معادلة الأكسدة الإرجاعية بين
1- أكتب المعادلتين النصفيتين لهذا التفاعل مبينا الثنائيات الداخلة في التفاعل .
2-أحسب كمية المادة الإبتدائية لكل متفاعل واستنتج إذا كان المزيج الإبتدائي سيتوكيومتري.
3-أنجز جدول تقدم التفاعل .
4-أحسب قيمة التقدم الأعظمي
5-أعطت الدراسة التجريبية الجدول التالي:
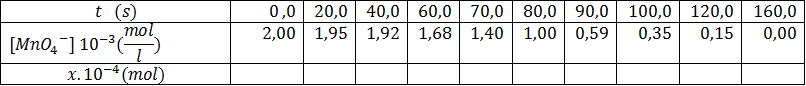
أ-املئ الجدول و أرسم البيان
ب-أحسب التركيز المولي الحجمي لحمض الأكساليك عند اللحظة
ﺠ-حدد بيانيا زمن نصف التفاعل
د-عرف السرعة الحجمية للتفاعل ثم بين انه يمكن أن تكتب بالشكل :
ه-أحسب السرعة الحجمية للتفاعل عند
و-ناقش البيان ، ماهي الظاهرة المشاهدة . هل هذه الوساطة متجانسة أو غير متجانسة ،علل؟
1- أكتب المعادلتين النصفيتين لهذا التفاعل مبينا الثنائيات الداخلة في التفاعل .
2-أحسب كمية المادة الإبتدائية لكل متفاعل واستنتج إذا كان المزيج الإبتدائي سيتوكيومتري.
إذا المزيج الإبتدائي غير سيتوكيومتري
3-أنجز جدول تقدم التفاعل .
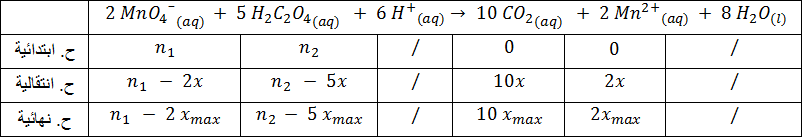
4-أحسب قيمة التقدم الأعظمي
( احتمال انتهاء
( احتمال انتهاء
5-أ-املئ الجدول و أرسم البيان

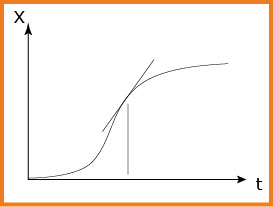
ب-أحسب التركيز المولي الحجمي لحمض الأكساليك عند اللحظة
ﺠ-حدد بيانيا زمن نصف التفاعل
بالاسقاط نجد
د-عرف السرعة الحجمية للتفاعل ثم بين انه يمكن أن تكتب
بالشكل :
هي مقدار التقدم عند لحظة معينة في واحدة الحجم
ه-أحسب السرعة الحجمية للتفاعل عند
و-ناقش البيان ، ماهي الظاهرة المشاهدة . هل هذه الوساطة متجانسة أو غير متجانسة ،علل؟
المرحلة الأولى السرعة معدومة لأن الوسيط لا يعمل بعد ، ثم السرعة تزداد( الانعطاف الأول ) لأن الوسيط بدأ تأثيره ، ثم السرعة تتناقص لأن المتفاعلات تتناقص و عليه التصادم الفعال يتناقص ، و أخيرا السرعة تنعدم لأن التفاعل انتهى . نوع الوساطة غير متجانسة و هو ظاهر في الانعطاف الأول .








