في وسط حمضي نجري أكسدة لشوارد اليود
نعتبر التفاعل بطيئا ونعطي الثنائيتين الداخلتين في التفاعل :
1-أكتب المعادلات النصفية الإلكترونية لكل من الأكسدة والإرجاع.
2-أكتب معادلة الأكسدة – إرجاع المنمذجة للتحول الحاصل .
3-لدراسة العوامل المؤثرة على هذا التحول قمنا بإنجاز التجارب التالية :
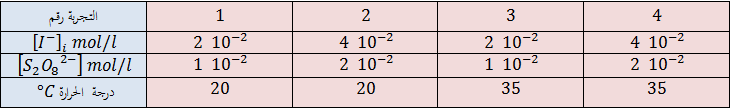
عند اللحظة

-1-3 حدّد التفاعل ذي السرعة الأكبر في التجربتين
-2-3 ما تأثير العامل الحركي المذكور على زمن التفاعل ؟
4-مزجنا في الحالة الابتدائية حجما قدره
-1-4أحسب التراكيز المولية الابتدائية لكل من الشاردتين :
-2-4ما رقم التجربة الموافقة لحالة هذا المزيج؟
-3-4أحسب التركيز المولي لمحلول ثنائي اليود المتشكل في الحالة النهائية
-4-4هل ينتهي التفاعل عند اللحظة
5-4- في التجربة
1- المعادلتين النصفيتين
2- المعادلة الإجمالية
1-3- في التجربة
تركيز ثنائي اليود المتشكل عند اللحظة
سرعة التفاعل في التجربة
2-3- العامل الحركي يسرع التفاعل ويجعله ينتهي في مدة زمنية أصغر.
1-4-
2-4- هذه النتائج توافق التجربة
4-3- جدول التقدم:
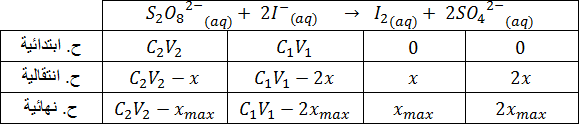
حالة
حالة
لا يوجد مفاعل محد
4-4- لم ينتهي التفاعل في اللحظة
5-4- لدينا :








