بوتانوات الميثيل معطر غذائي له رائحة التفاح، صيغته الجزيئية نصف المفصلة معطاة بالشكل :

1.1- ما هي العائلة الكيميائية التي ينتمي إليها بوتانوات الميثيل؟ وما هي المجموعة المميزة لجزيئه؟
2.1- يمكن اصناع بوتانوات الميثيل من تفاعل نوعين كيميائيين
3.1- أعط الصيغة نصف المفصلة واسم كل من المتفاعلين
4.1- اكتب معادلة التفاعل المنمذج لهذا الاصطناع. ما هو اسم هذا التفاعل؟
2- في اللحظة
درجة حرارة الوسط التفاعلي تبقى ثابتة عند
حيث
1.2- أنشئ جدول تقدم تفاعل الاصطناع.
2.2- أوجد العلاقة بين كميات المادة

3.2- القياسات التجريبية سمحت بتحديد كميات المادة للحمض الكربوكسيلي و بوتانوات الميثيل المتواجدة في المزيج أثناء تفاعل الاصطناع ورسم المنحنيين التاليين:
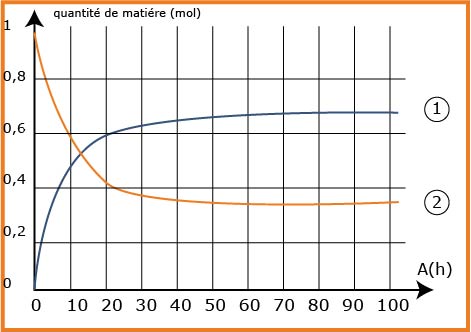
- حدّد، مع التعليل، منحنى تطور كمية كل من بوتانوات الميثيل والحمض الكربوكسيلي.
4.2- احسب نسبة التقدم النهائي للتحوّل المدروس.
5.2- ما هي خواصّ هذا التحوّل البارزة في هذه الدراسة؟
6.2- اقترح طريقة لتقليص مدّة التفاعل دون تغيير طبيعة المتفاعلات.
3- لتعيين كمية مادة الحمض الكربوكسيلي المتبقي في نهاية التفاعل الذي سنرمز له
1.3- اكتب معادلة تفاعل المعايرة.
2.3- أنشئ جدول تقدم تفاعل المعايرة.
3.3- عرّف التكافؤ في المعايرة. اقترح طريقة لتحديد حالة التكافؤ.
4.3- احسب كمية مادة الحمض
1.1- العائلة الكيميائية التي ينتمي إليها بوتانوات الميثيل: الإسترات.
المجموعة المميزة لجزيئه هي:
2.1- العائلة الكيميائية التي ينتمي إليها النوع
3.1-
4.1- هذا التفاعل يسمى أسترة:
1.2- جدول تقدم تفاعل الاصطناع.
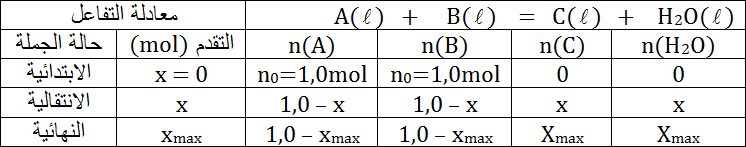
2.2- من جدول التقدم نجد:
ومنه
إذن:
- منحنى تطور كمية بوتانوات الميثيل هو:
ومنحنى تطور كمية الحمض الكربوكسيلي هو:
4.2- حساب نسبة التقدم النهائي: من المنحنى نجد:
من جدول التقدم نجد:
ومنه:
5.2- خواصّ هذا التحوّل: بطيء، محدود (عكوس)
6.2- لتقليص مدّة التفاعل دون تغيير طبيعة المتفاعلات نرفع درجة الحرارة (أو نضيف وسيط شوارد
1.3- معادلة تفاعل المعايرة:
2.3- جدول تقدم تفاعل المعايرة:

3.3- التكافؤ في المعايرة هو حالة الجملة لحظة تغيّر المتفاعل المحدّ فيكون المتفاعلان بنسبة ستوكيومترية ( أي عند اختفاء المتفاعلان تماماً). يمكن تحديد حالة التكافؤ هنا بتغيّر لون الكاشف الملون المضاف في بداية التجربة.
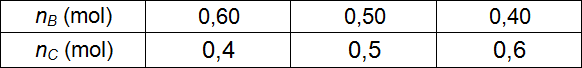
4.3- عند التكافؤ:
ومنه:
ويكون:
وهذه النتيجة موافقة للمنحنى البياني لتطور كمية مادة الحمض الكربوكسيلي








