يتدخل الأنزيم في تفاعلات الأيض الخلوية كما يكون تأثيره نوعيا
1 - تمثل الوثيقة(1) تغيرات الحركية الأنزيمية بتغير تركيز مادة التفاعل.
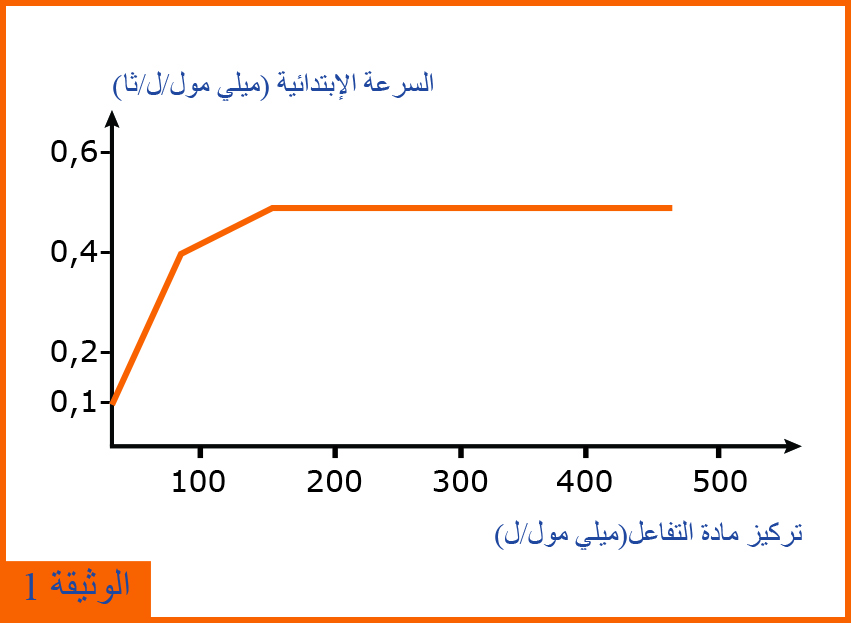
- حلل نتائج الوثيقة (1) وماذا تستنتج ؟
- إقترح تفسيرا لثبات تغيرات سرعة التفاعل الأنزيمي عند التراكيز العالية من مادة التفاعل.
- نمذج عن طريق رسومات تخطيطية العلاقة بين الأنزيم ومادة التفاعل عند التراكيز (100 و 400 ميلي مول/ل)
- هل تأكدت من تفسيرك المقترح في السؤال 2 ؟ علل
2 - يمثل الشكل (أ) من الوثيقة (2) نمذجة جزيئية للتحفيز الأنزيمي للأميلاز البنكرياسي
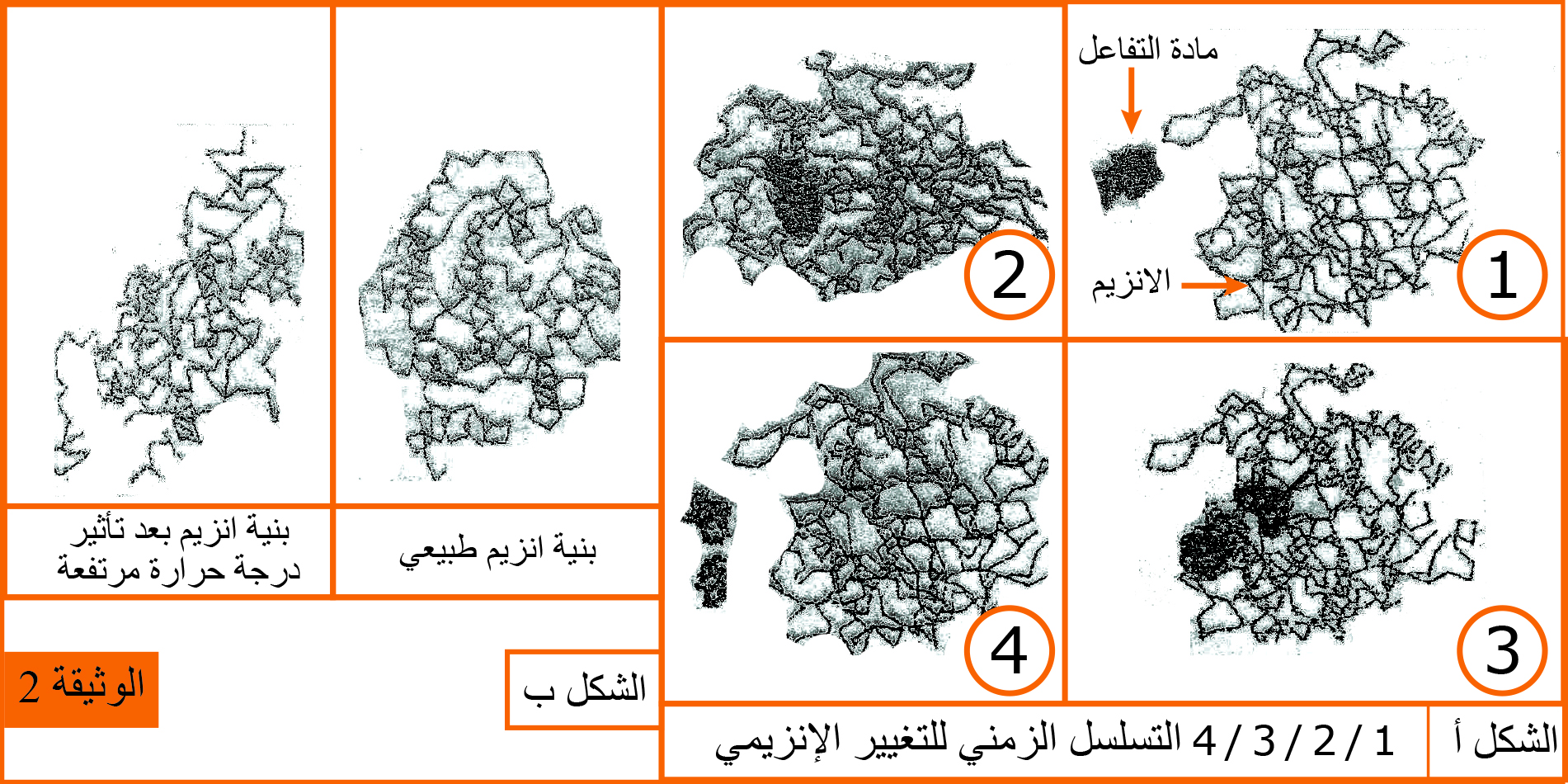
- حلل الشكل (أ) من الوثيقة (2) وماذا تستخلص من هذا التحليل ؟ دعم إجابتك بمعادلة بسيطة.
- من خصائص الأنزيم أن أغلب الأحماض الأمينية لا تشارك في التفاعل مباشرة، وضح ذلك.
- يتأثر نشاط الأنزيم بالحرارة المرتفعة كما هو موضح في الشكل (ب) من الوثيقة (2)
ا - فسر تأثير درجة الحرارة المرتفعة على النشاط الأنزيمي.
ب - باستغلال الوثيقة (2) ومعلوماتك، ماذا يمكن إستخلاصه فيما يخص العلاقة بين البنية الفراغية للأنزيم وتخصصه الوظيفي ؟
1 - تحليل نتائج الوثيقة 1:
من(0-100) ميلي مول/ ل / ثا تزايد سريع للسرعة بتزايد تركيز مادة التفاعل حتى تبلغ القيمة 0 ,4 ميلي مول / ل/ ثا
من (100-200) ميلي مول/ ل / ثا تزايد بطيء للسرعة حتى تبلغ السرعة القصوى.
من (200 ميلي مول/ ل / ثا) فما فوق ثبات في السرعة رغم تزايد تركيز مادة التفاعل .
الإستنتاج: تتأثر سرعة التفاعل الإنزيمي بتركيز مادة التفاعل أو (تتناسب سرعة الإنزيمي طردا مع تركيز مادة التفاعل وتثبت عند التراكيز العالية )
- التفسير المقترح لثبات تغيرات السرعة عند التراكيز العالية من (S) هذا الثبات راجع إلى تشبع الأنزيم بمادة التفاعل.
- النمذجة :

- نعم تم التأكد من من صحة التفسير المقترح :
التعليل: للأنزيم مناطق ذات أعداد محددة هي الموقع الفعال الذي ترتبط به جزيئات مادة التفاعل وعند تشبعها تصل السرعة إلى أقصاهل فتثبت .
2 - تحليل الشكل أ: يبين الشكل بنية كل من الأنزيم ومادة التفاعل خلال تفاعل إنزيمي
الشكل 2: يبين تشكل المعقد(أنزيم – مادة التفاعل) وذلك بعد تغيير الأنزيم لشكل موقعه الفعال ليصبح مكملا لمادة التفاعل إنه التفاعل المحفز.
الشكل 3: يبين تفكيك مادة التفاعل .
الشكل 4: يبين انفصال نواتج التفاعل واسترجاع الأنزيم لشكل موقعه الفعال
الاستخلاص :يتطلب حدوث التفاعل الإنزيمي تشكيل المعقد ES نتيجة التكامل المحفز.
المعادلة البسيطة : E+ S ---> E`+ S -----> E`S ------> E+P1 + P2
- التوضيح : لا يشارك في التفاعل الأنزيمي إلا الأحماض الأمينية المكونة لجزء من الأنزيم هو الموقع الفعال وذلك لقدرتها على التعرف النوعي لمادة التفاعل عن طريق تشكل روابط كيميائية إنتقالية بين جذور هذه الأحماض الأمينية وجزء من مادة التفاعل.
- أ- تفسير تأثير درجة الحرارة المرتفعة على النشاط الأنزيمي:
الحرارة المرتفعة تعمل على تخريب بنية الأنزيم وذلك بتكسير الروابط الكيميائية التي تحافظ على هذه البنية الفراغية فيحدث فقدان نهائي لبنية الأنزيم وبالتالي فقدان وظيفته .
ب- العلاقة بين بنية الأنزيم وتخصصه الوظيفي:
تتوقف البنية الفراغية (ثلاثية الأبعاد)للأنزيم على تموضع فراغي محدد لأحماض أمينية محددة في أماكن محددة من السلسلة الببتيدية وفق الرسالة الوراثية مما يسمح بتشكل موقع فعال له بنية مكملة لمادة التفاعل.








