Considérons les 5 ions suivants :
1- Donner la configuration électronique de chacun des ions.
2- Situer l’atome correspondant à chaque ion dans le tableau périodique en précisant le numéro de sa période, le numéro de son groupe et le symbole de son sous groupe.
Remarque:
Dans le cas du
3-Attribuer (en le justifiant clairement !) à chacun des cinq atomes la valeur de son électronégativité (dans l’échelle absolue de Pauling) prise parmi les valeurs suivantes :
1,03 ; 1,59 ; 1,61 ; 2,81 et 4,03.
On sait que :
- Le fluor est l’élément le plus électronégatif du tableau périodique.
- Dans une même période plus le “Z“ augmente plus l’électronégativité augmente.
Donc :
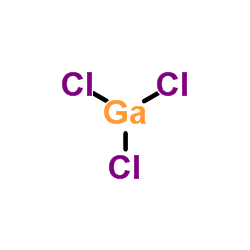
4- Donner la structure de Lewis du chlorure de gallium
Ga :
Cl :
Le Gallium étant dans son état excité possède 3 électrons célibataires qui vont créer des liaisons avec les 3 atomes de chlore.
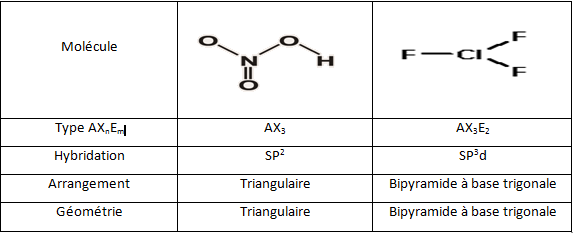
5- Etant donnés les atomes suivant :
- Le type auquel elle appartient.
- L’hybridation de l’atome central (qui est souligné).
- L’arrangement des paires électroniques de l’atome central.
- La géométrie de la molécule dans l’espace.