Etant donnés les atomes suivants :
Données :
1- Pour chacun de ces éléments , établir la configuration électronique à l'état fondamental et en déduire la position dans le tableau périodique (période ,groupe et sous groupe) pour chacun de ces éléments.
2- Classer ces éléments par ordre de rayon atomique croissant .
2- Classement par ordre de rayon atomique croissant :
- Dans une période quand "Z" augmente, le rayon "R" diminue.
- Dans un groupe quand "Z" augmente , le rayon "R" augmente .
3- Quels ions donneront préférentiellement Cl et Ba. justifier.
3- Les ions de Cl et Ba :
Justification :
Dans notre changement en ions on cherche la stabilité,
Quelle est la nature des liaisons dans
4- la nature des liaisons :
Les électronégativités de Cl et Ba sont très différentes, la liaison est donc de nature ionique (
5- Ecrire en notation de lewis les structures électroniques des espèces suivantes :
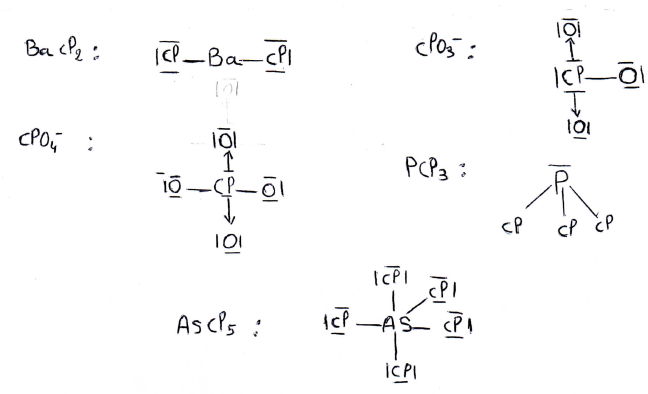
6- En utilisant les règles de Gillespie, basées sur la théorie (V.S.E.P.R);prévoir pour chacune des espèces précédentes:
- Le groupe d'appartenance .
- L'arrangement spatial le plus probable de toutes les paires électroniques de la couche de valence.
- La géométrie de la molécule dans l'espace.
- L'hybridation de l'atome central .
7- Le moment dipolaire de la molécule
- Calculer la charge nette portée par les atomes de phosphore et d'oxygène.
- Déterminer le caractère ionique partiel de la liaison .
7-
1. Calcul de la charge nette :
2.Détermination du caractère ionique :








