On se propose d'étudier la liaison S-O au moyen de la théorie quantique.
1- Donner le diagramme des orbitales moléculaires (OM) de la molécule SO, sachant que la différence d'énergie
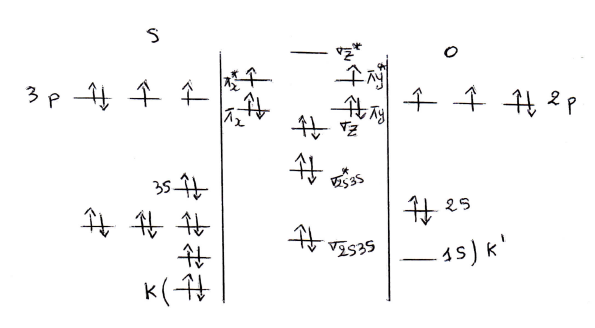
2- Ecrire la configuration électronique de cette molécule.
2- La configuration électronique :
3- Préciser le nombre et la nature des liaisons entre les deux atomes.En déduire la formule développée
3- Le nombre et la nature des liaisons :
Formule dévelopée:
4- Cette molécule est-elle paramagnétique ou diamagnétique?
4- Cette molécule posséde des électrons célibataires donc elle est paramagnétique.
5- On considère la molécule SO et ses ions
5- Plus l'ordre de liaison est élevé plus la distance est petite donc :
6- Le soufre et l'oxygène forment le composé SO.
Sachant que le moment dipolaire expérimental de cette molécule est 1,55 D.
Calculer la charge portée par chacun des deux atomes et en déduire le pourcentage du caractère ionique partiel de cette liaison.
6- Calcul de la charge :








