La combustion, dans un calorimètre (volume constant), d'une pastille de 24,40 g d'acide benzoique
Données :
- Température de fusion de
- Chaleur latente de vaporisation de l'eau à 373 K :
- Masse molaire de
- Enthalpie standard de formation à
| Composé | |||||
|---|---|---|---|---|---|
| 148,0 | 75,2 | 44,3 | 30,1 | 30,2 |
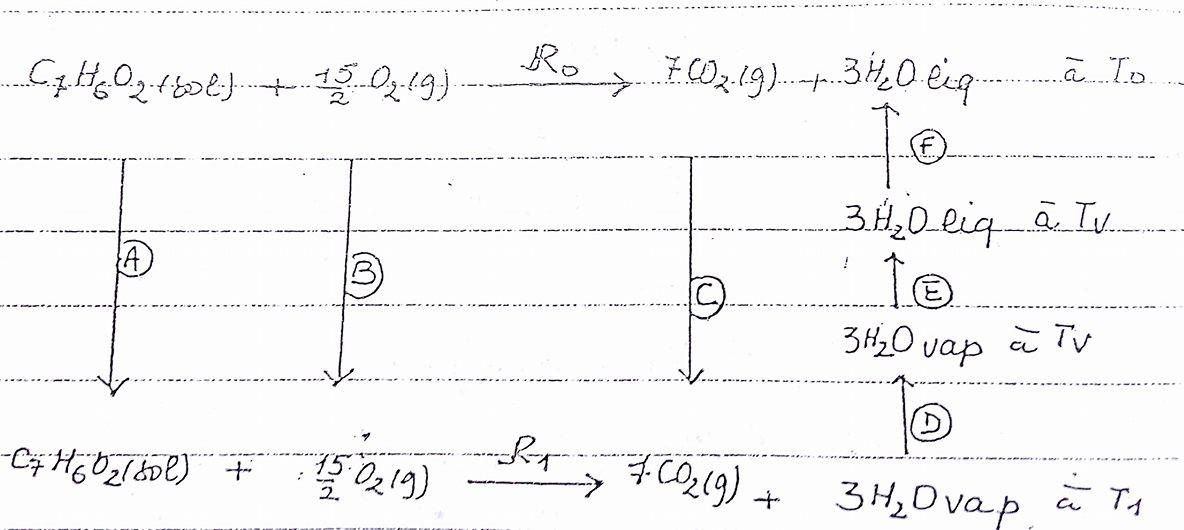
1- Ecrire la réaction de combustion de cet acide à la température
2- Calculer la valeur de l'énergie interne molaire de combustion de cet acide à la température
3- Déduire la valeur de l'enthalpie molaire de combustion de cet acide à
Avec
4- Calculer la valeur de l'enthalpie molaire de formation
5- Ecrire la réaction de combustion de l'acide benzoique à la température
6- Calculer l'enthalpie standard molaire de combustion de cet acide à
D'où
Avec :
Donc :