تطور كميات المتفاعلات و النواتج خلال تحول كيميائي في محلول مائي
هل تستغرق كل التحولات الكيميائية الحادثة نفس المدة الزمنية؟
نسكب تدريجيا محلول برمنغنات البوتاسيوم (.......................)على محلول كبريتات الحديد الثنائي (..........................)
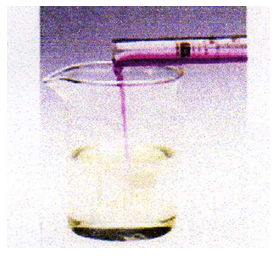
نمزج محلول يود البوتاسيوم الشفاف (.........................) مع بيروكسوديكبريتات البوتاسيوم الشفاف (..........................) و نراقب ما يحدث بعد الرج

الشكل
الشكل

- ماذا تلاحظ في كل تجربة ؟
ت
ت
ت
- هل المدة الزمنية المستغرقة هي نفسها في كل هذه التحولات ؟
.......................................................................................................................
- رتب التفاعلات السابقة حسب زمن حدوثها .
.......................................................................................................................
- اكتب معادلة التفاعل الحادث المنمذج لكل تجربة :
ت
ت
ت
التحولات السريعة ................................................
التحولات البطيئة ..................................................
التحولات البطيئة جدا ..........................................
نسكب تدريجيا محلول برمنغنات البوتاسيوم
على محلول كبريتات الحديد الثنائي
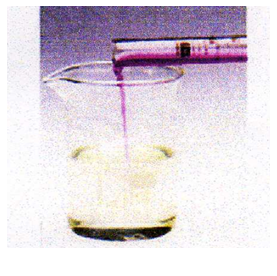
نمزج محلول يود البوتاسيوم الشفاف
و نراقب ما يحدث بعد الرج

الشكل
الشكل

- ماذا تلاحظ في كل تجربة ؟
ت
ت
ت
- هل المدة الزمنية المستغرقة هي نفسها في كل هذه التحولات ؟
لا المدة الزمنية مختلفة.
- رتب التفاعلات السابقة حسب زمن حدوثها .
ت
- اكتب معادلة التفاعل الحادث المنمذج لكل تجربة :
ت
ت
ت
التحولات السريعة:هي التي يصل فيها تطور الجملة إلى حالته النهائية عند تلامس المتفاعلات
التحولات البطيئة: هي التي يدوم فيها تطور الجملة عدة ثواني إلى عدة دقائق إلى عدة ساعات
التحولات البطيئة جدا:هي التي يدوم فيها تطور الجملة عدة أيام إلى عدة أشهر إلى عدة سنوات فنقول أن الجملة عاطلة حركيا.
Ι) نمزج

- ماذا تلاحظ ؟
- أكتب معادلة التفاعل المنمذج للتحول الكيميائي الحادث في أحد الأجزاء .
- أنجز جدول تقدم هذا التفاعل .
ΙΙ)لتعيين كمية اليود المتشكل في اللحظة
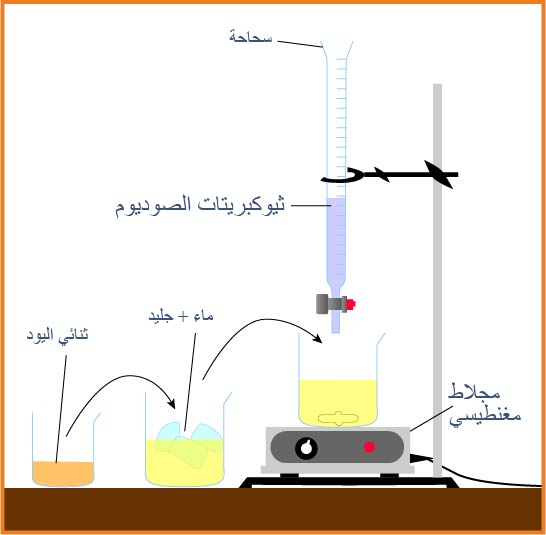
- أكتب معادلة تفاعل المعايرة .
- أكتب جدول تقدم المعايرة
- كيف يمكن إيجاد كمية ثنائي اليود في المزيج ؟
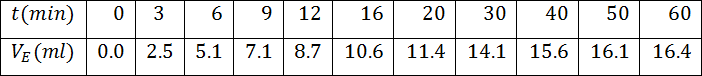
- أكمل الجدول التالي عندئذ .
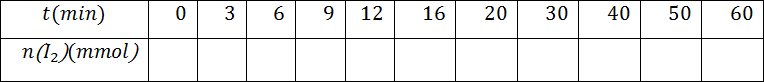
- ما هي العلاقة بين كمية مادة ثنائي اليود المتشكل عند اللحظةوتقدم التفاعل المدروس و استنتج الجدول التالي
- أرسم البيان
- ماذا تستنتج ؟
Ι) نمزج
- ماذا تلاحظ ؟ تزايد شدة لون المحلول نتيجة تشكل اليود .
- أكتب معادلة التفاعل المنمذج للتحول الكيميائي الحادث في أحد الأجزاء .
- أكتب جدول تقدم هذا التفاعل .
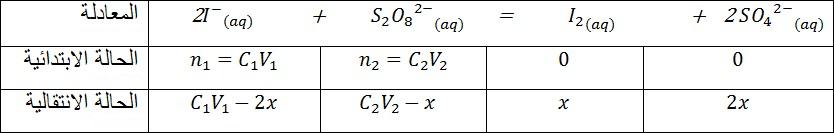
ΙΙ)لتعيين كمية اليود المتشكل في اللحظة
ثم نعاير العينة بواسطة محلول تيوكبريتات الصوديوم حتى يصبح لون المحلول أصفرا ثم نضيف قطرات من صمغ النشا ليصبح لون المحلول أزرق.و عند بلوغ التكافؤاختفاء اللون الأزرق دلالة على تفاعل
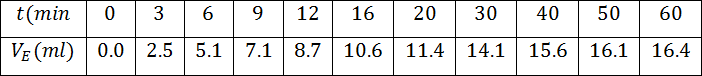
- أكتب معادلة تفاعل المعايرة
- أكتب جدول تقدم المعايرة
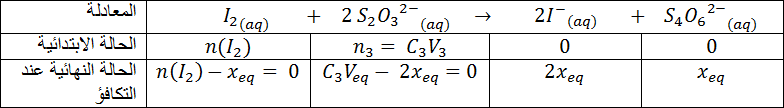
- كيف يمكن إيجاد كمية ثنائي اليود في المزيج ؟
إنها تعبر عن كمية اليود المتشكلة في كل أنبوب اختبار دو حجم
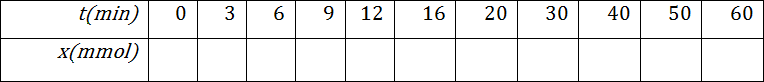
4.أكمل الجدول التالي عندئذ

- ما هي العلاقة بين كمية مادة ثنائي اليود المتشكل عند اللحظةوتقدم التفاعل المدروس
و استنتج الجدول التالي

- أرسم البيان
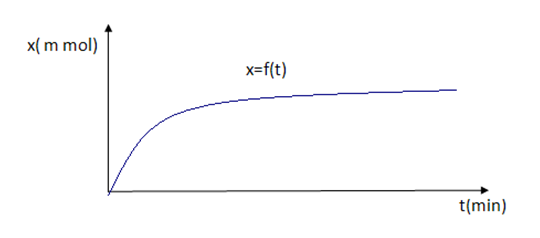
- ماذا تستنتج ؟
عملية المعايرة تمكننا من متابعة تطور تحول كيميائي
ندرس تفاعل إماهة
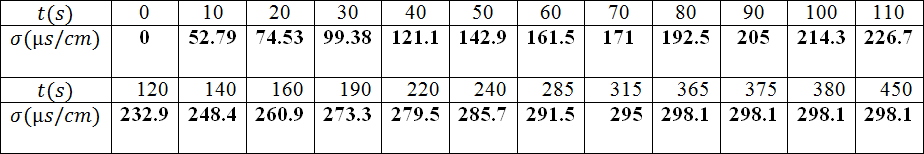
حيث معادلة التفاعل المنمذج لهذا التحول :
- اشرح لماذا يمكن من متابعة هذا التحول عن طريق قياس الناقلية
- ما هي عبارة الناقلية النوعية لهذا المحلول ؟
- أحسب كميات المادة الابتدائية للمتفاعلات
- أنشئ جدولا لتقدم التفاعل
- أكتب العبارة الحرفية للناقلية النوعية للمحلول بدلالة التقدم.
- لماذا تكون الناقلية النوعية للوسط التفاعلي معدومة في اللحظة ؟
- أعط عبارة الناقلية النوعية في نهاية التفاعل .
- أحسب التقدم الأعظمي
- انطلاقا من العبارات المتحصل عليها في السؤال و قيمة، عين عبارة التقدمفي اللحظةبدلالةو.
- أنجز جدولا لقيم التقدم في اللحظات المختلفة.
- أرسم البيان
السلم :
الفواصل
ندرس تفاعل إماهة
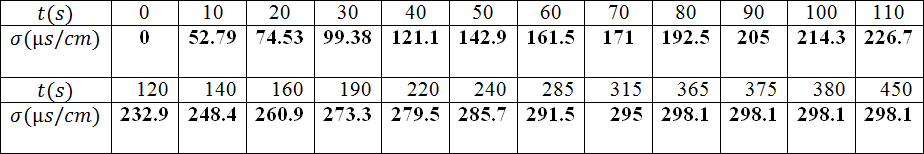
حيث معادلة التفاعل المنمذج لهذا التحول :
- اشرح لماذا يمكن من متابعة هذا التحول عن طريق قياس الناقلية
يمكن متابعة هذا التحول عن طريق قياس الناقلية لأن في المزيج المتفاعل توجد شوارد و
- ما هي عبارة الناقلية النوعية لهذا المحلول ؟
- أحسب كميات المادة الابتدائية للمتفاعلات
- أنشئ جدولا لتقدم التفاعل
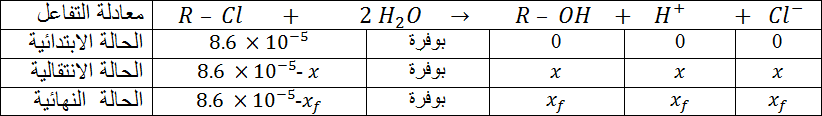
- أكتب العبارة الحرفية للناقلية النوعية σ للمحلول بدلالة التقدم .
- لماذا تكون الناقلية النوعية للوسط التفاعلي معدومة في اللحظة ؟
تكون الناقلية معدومة في اللحظة
- أعط عبارة الناقلية النوعية في نهاية التفاعل .
- أحسب التقدم الأعظمي
- انطلاقا من العبارات المتحصل عليها في السؤال و قيمة، عين عبارة التقدمفي اللحظةبدلالةو.
بتقسيم العلاقتين
نتحصل على
- أنجز جدولا لقيم التقدم في اللحظات المختلفة.
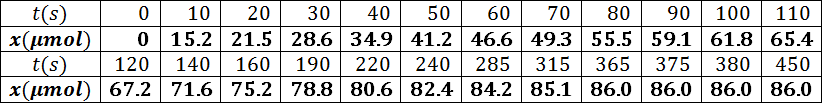
- أرسم البيان
السلم :
الفواصل
المؤكسد : هو كل فرد كيميائي قادر على اكتساب الكترون أو أكثر
المرجع : هو كل فرد كيميائي قادر على فقدان الكترون أو أكثر
الثنائية مرجع / مؤكسد : هي مجموعة مكونة من مؤكسد و مرجع مرافق و نرمز لها
تفاعل أكسدة أرجاع : هو تبادل الكتروني بين الثنائيتين
- تحولات سريعة :هي تحولات آنية بمجرد تلامس المتفاعلين و يتم خلال مدة قصيرة جدا لا يمكن متابعتها بالعين الجردة ( بعض الثوان ).
- تحولات بطيئة : هي تحولات تدريجية و يتم خلال مدة معتبرة يمكن متابعتها بالعين الجردة ( عدة ثواني ).
- تحولات بطيئة جدا: هي تحولات تتم خلال مدة كبيرة ساعات، أيام ، أشهر ...) فنقول الجملة عاطلة حركيا .
يوجد عدة طرق عندما تكون إحدى المقادير الفيزيائية قابلة للقياس :
- قياس الناقلية ( الوسط التفاعلي يحتوي على شوارد )
- قياس الحجم أو الضغط ( إذا كان التفاعل ينتج أو يستهلك غاز )
- المعايرة (تتم المعايرة المتقطعة على عينات )
- قياس ال ( الوسط التفاعلي يحتوي على شوارد الهيدرونيوم)
هو الزمن اللازم لكي يصل التفاعل إلى نصف تقدمه الأعظمي
عند اللحظة
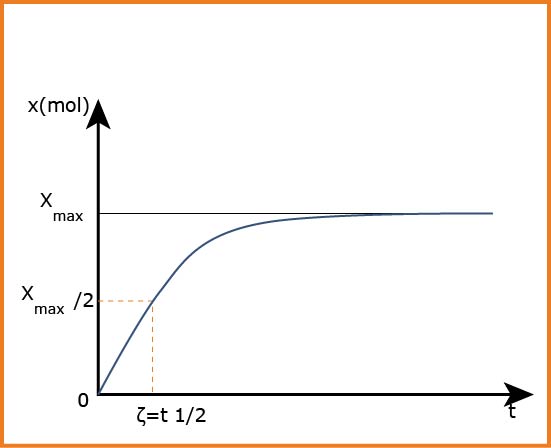
تبين التجارب أن جملة كيميائية يميزها زمن تصف التفاعل حيث تتوقف تطور الجملة عندما
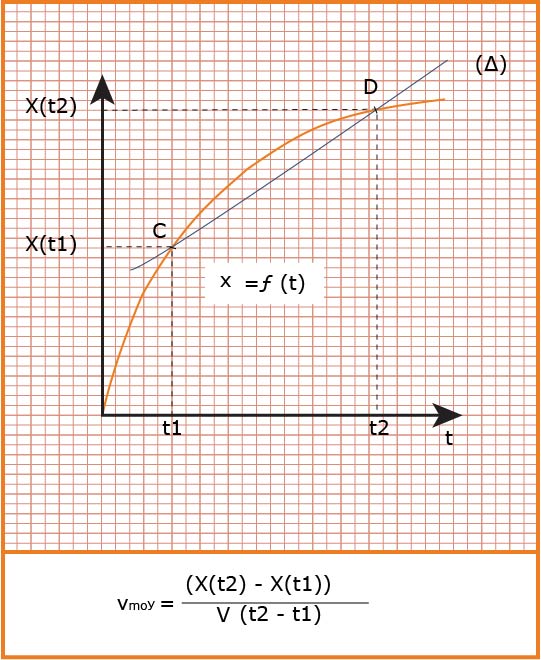
هي التغير في كمية مادة
تعين بيانيا
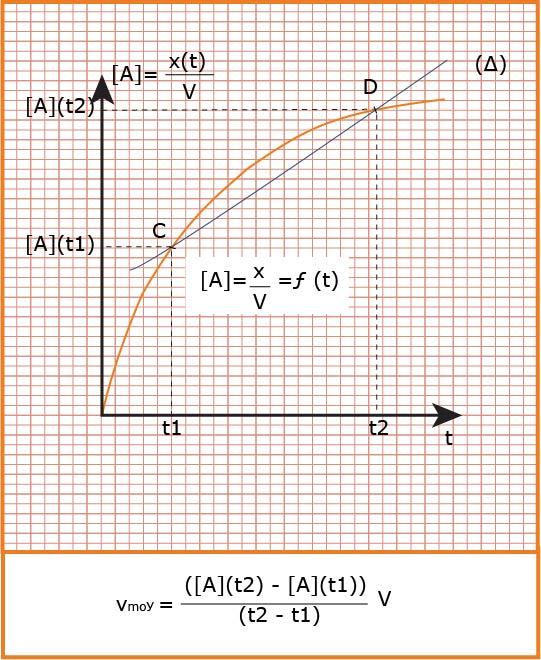
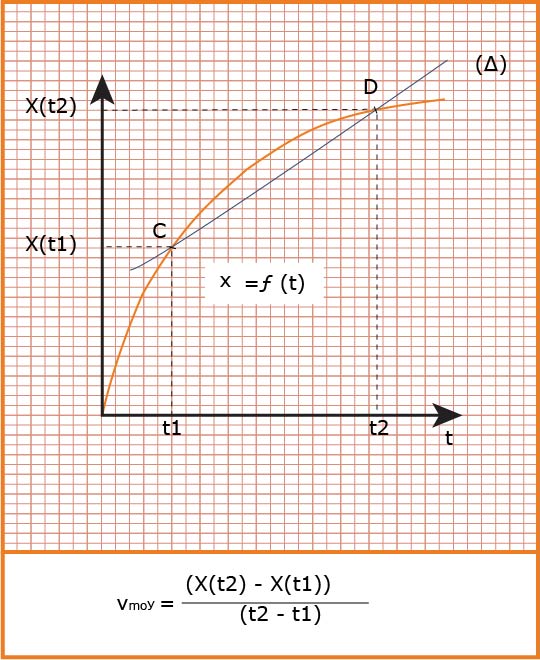
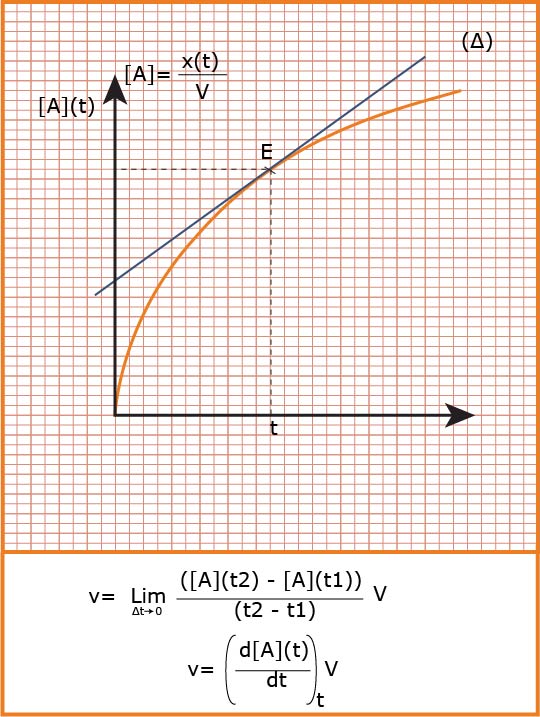
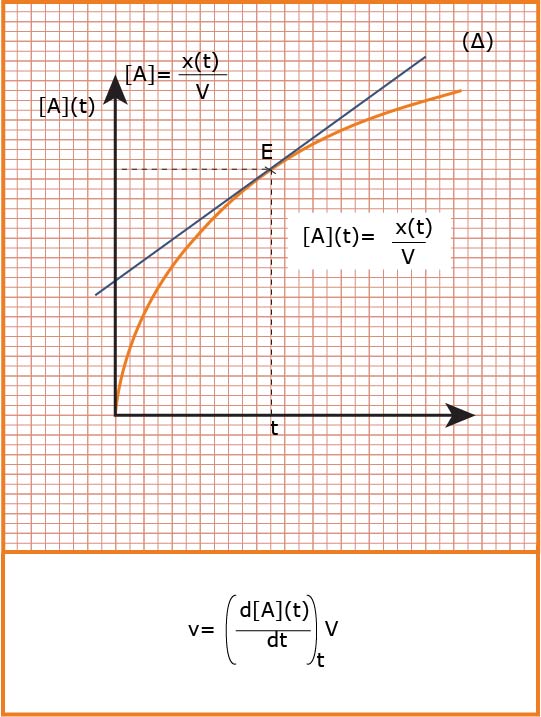
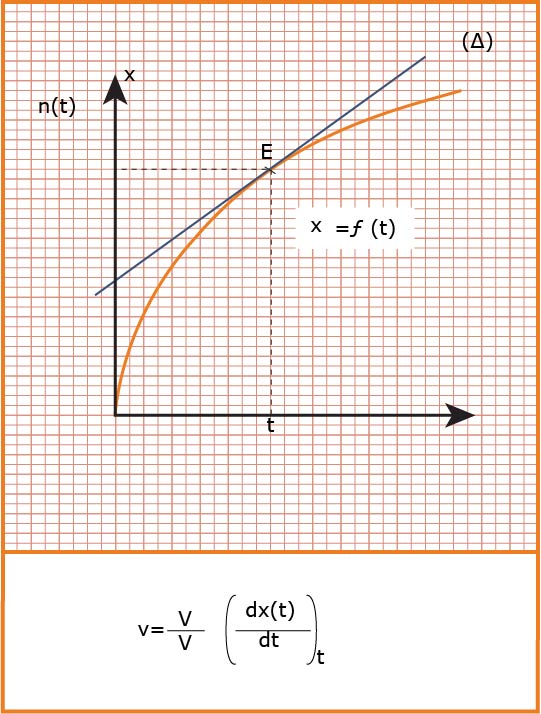
تؤول السرعة الوسطية إلى سرعة لحظية عندما المجال الزمني يؤول إلى الصفر فنكتب :
تعين بيانيا :
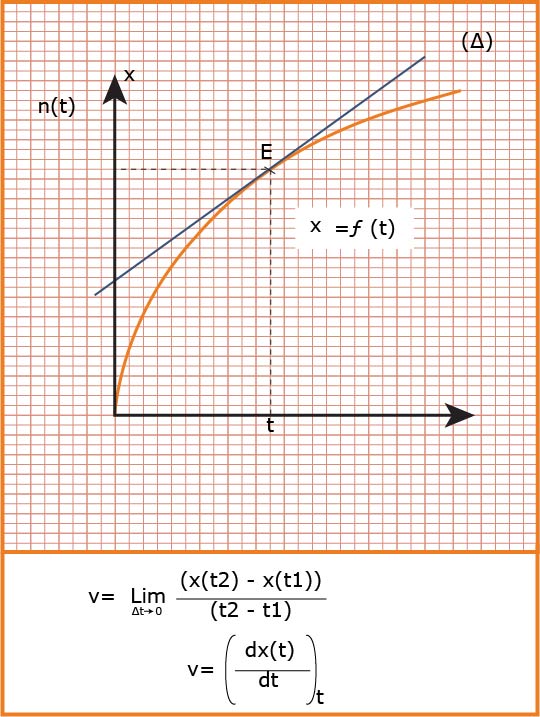
هي التغير في كمية مادة
تعين بيانيا :
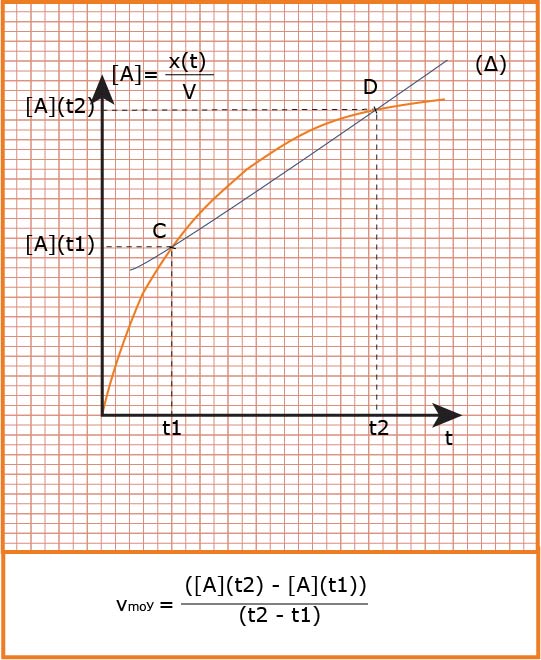
هي عدد المولات المختفية أو المتشكلة خلال مدة تشكلها أو اختفائها في وحدة الحجم .
تعين بيانيا
- لماذا نحافظ على المأكولات في الثلاجة ؟
- لماذا نضيف إلى جملة كيميائية ماء باردا أو جليدا ؟
- لماذا يحضر الأكل بسرعة في طنجرة الضغط ؟
- كيف تفسر بعض التفاعلات البيوكيميائية ؟
تتعلق العوامل الحركية لتحول كيميائي ب:
- ....................................
- ....................................
- ....................................
نضع في بيشرين
نضيف إلى البيشرين محلول برمنغنات البوتاسيوم البنفسجي اللون

................................................................................................
كلما ارتفعت درجة حرارة الوسط التفاعلي, كلما كانت مدة التحول .............. مما يؤدي إلى ............... اختفاء متفاعل أو ظهور ناتج.
نأخذ بيشرين و نضع بها

.....................................................................................................................
كلما تزايد التركيز المولي الابتدائي للمتفاعلات كلما كانت مدة التحويل .............. و التفاعل ..................
نأخذ
علما أن الماء الأكسجيني يتحلل إلى ماء و ثنائي الأكسجين حسب المعادلة الكيميائية : ........................................................................................

......................................................................................................................................
كل من البلاتين , محلول كلور الحديد III و الكبد تعتبر ..... و لعبت نفس الدور و لكن بأشكال مختلفة حيث:
- الوساطة بقطعة البلاتين, تصاعد .... كثيف على سطح المحلول نقول وساطة غير متجانسة لأن ..................
- الوساطة بواسطة شوارد ..................... يظهر في المحلول. نقول وساطة متجانسة لأن ...................
- الوساطة بالكبد تعود إلى وجود ........... الذي هو موجود في الدم. نقول وساطة أنزيمية لأن ...................
عندما ترتفع درجة حرارة جملة كيميائية فإن ..............................................................
عندما يزداد عدد الأفراد الكيميائية المتواجدة في حجم معين فإن .........................................
الوسيط يقدم .................. لتفكيك الروابط وتشكيل أفراد كيميائية جديدة و هو ............... في .................... التفاعل
- التركيز المولي للمتفاعلات :.......................................................................................
- درجة الحرارة :.........................................................................................
- الوسيط:..............................................................................................................
- لماذا نحافظ على المأكولات في الثلاجة ؟ حتى نبطئ سرعة تطور التفاعل البيوكيميائي .
- لماذا نضيف إلى جملة كيميائية ماء باردا أو جليدا ؟ لتوقيف التفاعل
- لماذا يحضر الأكل بسرعة في طنجرة الضغط ؟ لتسريع تطور التفاعلات الناتج عن ارتفاع درجة الحرارة لزيادة الضغط .
- كيف تفسر بعض التفاعلات البيوكيميائية ؟ تساعد على تحليل الجزيئات مما يؤدي إلى تسريع التفاعل.
تتعلق العوامل الحركية لتحول كيميائي ب:
- درجة الحرارة
- التركيز الابتدائي للمتفاعلات
- الوساطة
نضع في بيشرين
نضيف إلى البيشرين محلول برمنغنات البوتاسيوم البنفسجي اللون

اختفاء اللون البنفسجي في الوعاء B أسرع منه في الأنبوب A .
كلما ارتفعت درجة حرارة الوسط التفاعلي, كلما كانت مدة التحول قصيرة مما يؤدي إلى تسريع اختفاء متفاعل أو ظهور ناتج.
نأخذ بيشرين و نضع بها

ظهور اللون في الوعاء
كلما تزايد التركيز المولي الابتدائي للمتفاعلات كلما كانت مدة التحويل قصيرة و التفاعل أسرع .
نأخذ
علما أن الماء الأكسجيني يتحلل إلى ماء و ثنائي الأكسجين حسب المعادلة الكيميائية :
:

انطلاق غاز ( يزيد اشتعال اللهب -
كل من البلاتين , محلول كلور الحديد III و الكبد تعتبر وسائط و لعبت نفس الدور و لكن بأشكال مختلفة حيث:
- الوساطة بقطعة البلاتين, تصاعد غاز كثيف على سطح المحلول نقول وساطة غير متجانسة لأن الحالة المادية تختلف عن الحالة المادية التي تكون فيها الأفراد الكيميائية المتحولة في الجملة الكيميائية .
- الوساطة بواسطة شوارد , غاز كثيف يظهر في المحلول. نقول وساطة متجانسة لأن الوسيط في نفس الحالة المادية التي تكون فيها الحالة المادية للأفراد الكيميائية المتحولة في الجملة الكيميائية .
- الوساطة بالكبد تعود إلى وجود أنزيم الذي هو موجود في الدم. نقول وساطة أنزيمية لأن الوسيط من طبيعة حيوية كالأنزيمات
عندما ترتفع درجة حرارة جملة كيميائية فإن حركة الأفراد المتواجدة بداخلها تزداد، و هو ما يؤدي إلى ارتفاع في تواتر التصادمات التي تحدث بين هذه الأفراد. كما أن ارتفاع درجة الحرارة تزيد في احتمال حدوث تصادمات فعالة بين هذه الأفراد مما يؤدي إلى زيادة في طاقتها الحركية، الشيء الذي يزيد من سرعة الأفراد.
عندما يزداد عدد الأفراد الكيميائية المتواجدة في حجم معين فإن التصادمات بين الأفراد تزداد مما يؤدي إلى زيادة احتمال حدوث تصادمات فعالة بين الأفراد المتفاعلة. و عليه كلما كان تركيز المتفاعلات أكبر كلما كانت سرعة التفاعل أكبر .
الوسيط يقدم طاقة لتفكيك الروابط وتشكيل أفراد كيميائية جديدة و هو يساهم في تسريع التفاعل .
- التركيز المولي للمتفاعلات : توقيف أو تسريع تفاعل كيميائي إذا كان التفاعل عنيفا أو بطيئا.
- درجة الحرارة : توقيف أو تسريع تفاعل كيميائي مثل حفظ الأكل أو طهيه .
- الوسيط: يلعب الوسيط دور كبير في البيوكيمياء (مثل الطب) بالإضافة إلى الأهمية في الصناعة.
إن العوامل الحركية هي عوامل تسمح لنا بتسريع التفاعل إن كان بطيئا و كذلك توجيهه لكي نحصل على الناتج المرغوب فيها. هذا يعني أن التحكم في العوامل الحركية يسمح لنا بالتحكم في التحول الكيميائي الحادث في جملة كيميائية معينة. وتتمثل العوامل الحركية في تراكيز الأفراد المتفاعلة، درجة الحرارة و الوسيط.
عندما نقوم بطبخ المواد الغذائية فإننا نقوم بتفاعل أو تفاعلات كيميائية. ومدة طبخ الغذاء تكون قصيرة كلما كانت درجة الحرارة مرتفعة. و لتجنب احتراق هذه المواد أثناء طبخها، نجعل ذلك يتم في وسط رطب
تنظيم درجة الحرارة يسمح لنا بتجنب جموح التفاعلات التي تكون ناشرة للطاقة و كذلك نتجنب حدوث تفاعلات طفيلية والتي تحدث بشكل موازي للتفاعل الرئيسي. أغلب الحوادث و الكوارث التي تحدث في المصانع الخاصة بالمواد الكيميائية سببها يعود إلى سوء تنظيم وعدم التحكم في درجة الحرارة، و هو ما حدث عام
لقد حدثت هذه الكارثة يوم
إن أغلبية المواد الغذائية هي مواد عضوية مأخوذة من كائنات حية، نباتية أو حيوانية. عندما نقوم بنزع هذه المواد من وسطها الطبيعي فإنها تصبح غير محمية بواسطة التفاعلات المنظمة التي تضمن استقرار المادة الحية. فهي تتفكك تحت تأثير الكائنات المجهرية
عندما نجعل درجة الحرارة تنخفض تصبح هذه التفاعلات بطيئة جدا: في الثلاجة تكون درجة الحرارة تقارب
في أغلب الحالات، وأثناء تحول كيميائي معين، هناك مجموعة من التفاعلات الكيميائية تحدث في هذا التحول. في هذه الحالة يجب استعمال وسيط لتسريع أحد التفاعلات عن التفاعلات المتبقية.
عندما يستعمل الكيميائي وسيطا فإنه يوجه التحول الكيميائي نحول تفاعل محدد و هو بذلك يفضل ناتجا معين عن بقية النواتج الأخرى التي يكون من الممكن أن تنتج أثناء التحول الكيميائي. فمثلا عندما نقوم بتسخين بخار الايثانول
وعندما نقوم بنفس العملية و لكنه بوجود وسيط آخر الذي هو الألومين
- إختبارات
- 20
- الأجوبة الصحيحة
- False
- الأجوبة الخاطئة
- False
- مجموع النقاط
- False
المراتب الخمس الأولى في Quiz
- ilyas yahia
- 260 نقطة
-

- NINA HANINE
- 220 نقطة
-

- amdjed sahra
- 220 نقطة
-

- rami razi
- 220 نقطة
-

- douha semari
- 220 نقطة
-

- HIBA MOULAI
- 215 نقطة
-

- حسين دهيني
- 200 نقطة
-

- abdelkader zoubiri
- 200 نقطة
-

- Wafia Lou
- 200 نقطة
-

- Kø Zï
- 200 نقطة
-









