مراقبة تطور جملة كيميائية
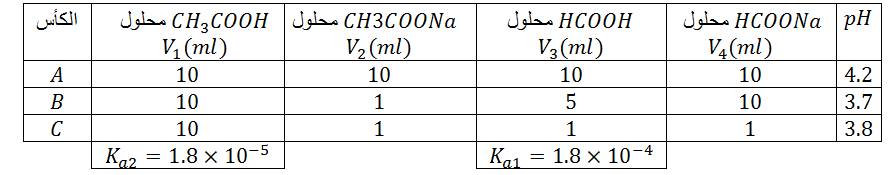
في ثلاثة كؤوس بيشر
بعد الرج نقيس
معادلة التفاعل الحادث :
ثابت التوازن :
دراسة النسبة :
في الكأس
الحالة الابتدائية :
........................................................................................................................................................................................
........................................................................................................................................................................................
الحالة النهائية :
...........................................................................................................................................
كسر التفاعل :
- الحالة الابتدائية : .....................................................
- الحالة النهائية : .....................................................
ملاحظة: في الكأس
بنفس الطريقة ندرس المحاليل في
في الكأس
في الكأس
النتيجة :
........................................................................................................
........................................................................................................
........................................................................................................
........................................................................................................
........................................................................................................
ملاحظة هامة: الدراسة السابقة تنطبق على التحولات حمض-أساس، كما تنطبق على التحولات أكسدة-إرجاع.
نتيجة: كل جملة كيميائية تتطور تلقائيا نحو حالة توازنها.

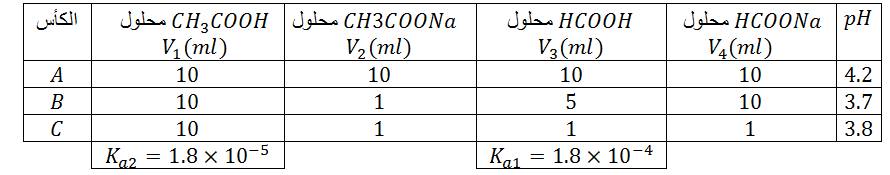
في ثلاثة كؤوس بيشر
معادلة التفاعل الحادث :
ثابت التوازن :
دراسة النسبة :
في الكأس
الحالة الابتدائية :
الحالة النهائية :
كسر التفاعل :
ملاحظة:
بنفس الطريقة ندرس المحاليل في
في الكأس
في الكأس
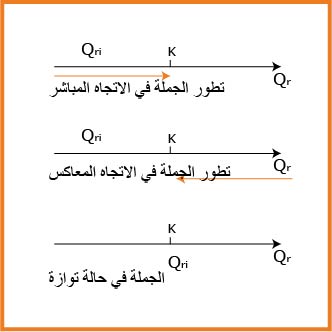
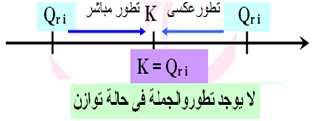
ان قيمة كسر التفاعل الابتدائية
نحدد هل الجملة فى حالة تطور ام لا
فاذا كان
واذاكان
1.اذاكان
2.اذاكان
الصيغة العامة : ان الصيغة العامة للكحولات احادية الوظيفة المشبعة هة من الشكل
الصيغة المجملة :
حيث
التسمية : يشتق اسم الكحول من الالكان باضافة المقطع ول .
والجد ول التالى يمثل بعض الامثلة
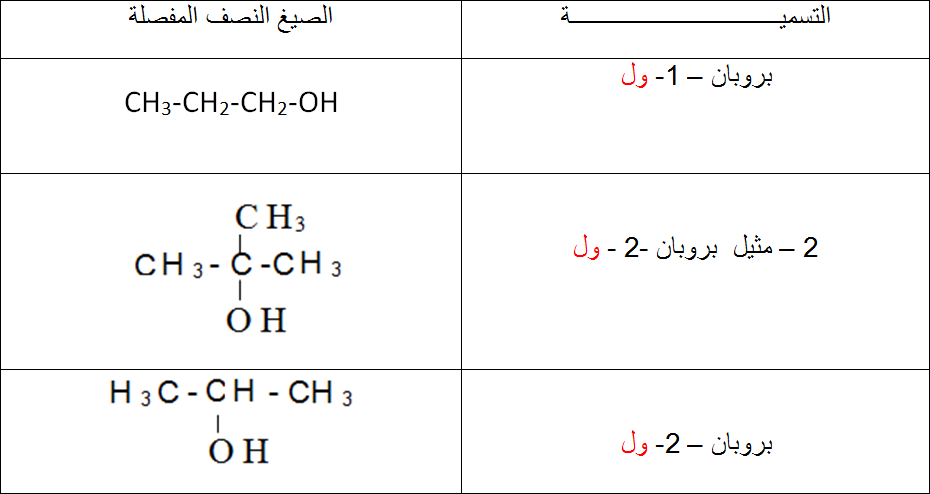
اصنا ف الكحولات
- الكحول الاولى : وصيغته العامة من الشكل التالى
- الكحول الثانوى: وصيغته العامة من الشكل
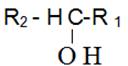
- الكحول الثالثى : وصيغته العامة من الشكل
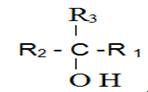
مثال : اليك الصيغة المجملة للكحول التالى الاحادى الوظيفة المشبع
اكتب الصيغ النصف مفصلة الممكنة مع التسمية وتحديد الصنف
الصيغة العامة : ان الاحماض الكربوكسيلية احادية الوظيفة والمشبعة صيغتها العامة هى من الشكل
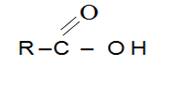
او
الصيغة المجملة : الصيغة المجملة للاحماش الكربوكسيلية هى
التسمية :يشتق اسم الحمض من الالكان متبوع بالمقطع ويك
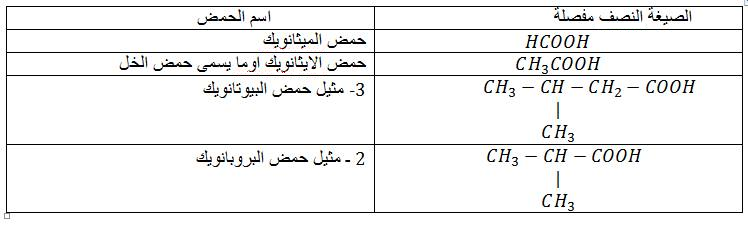
الصيغة العامة : ان الاستر ينتج من تفاعل الحمض الكربوكسيلى والكحول وتكون صيغتها العامة
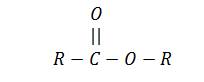
او
الصيغة المجملة : الصيغة المجملة للاسترات هى
التسمية :
1 ـ فى حالة
يكون اسم الاستر هو ألكانوات الالكيل
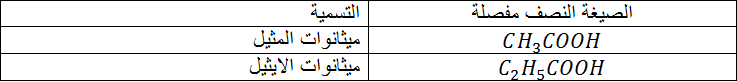
2 ـ فى حالة
نجدها في الفواكه، الخضر، الأزهار، الزيوت... .و يمكن اصطناعها من الكحولات و الأحماض الكربوكسيلية.
هو تفاعل حمض كربوكسيلي مع كحول فينتج أستر و ماء.
معادلة التفاعل المنمذج للتحول هي:
انجز جدول تقدم التفاعل
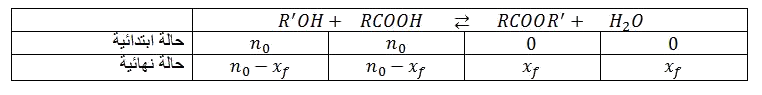
نتائج التجربة أعطت البيان التالي :
ـاحسب النسبة النهائية لتقدم التفاعل
ـناقش البيان.
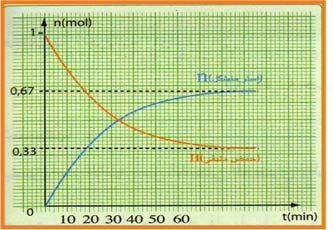
من خلال المنحنى
عند نهاية التفاعل
اذا كان التحول تاما
في حالة مزيج ابتدائي متساوي كمية المادة (متساوي عدد المولات) من الحمض الكربوكسيلي و الكحول فإن مردود الأسترة يتعلق بصنف الكحول
- إذا كان الكحول أوليا
- إذا كان الكحول ثانويا
- إذا كان الكحول ثالثيا
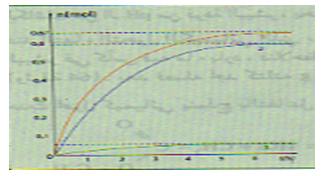
بما أن حجم المزيج التفاعلي نفسه و ثابت فإن
- كحول أولي :
- كحول ثانوي :
- كحول ثالثي:
عندما يكون التفاعل غير متساوي المولات فإن
- نسبة التقدم النهائي يتغير
- المردود يتغير
- بينما ثابت التوازن يبقى ثابتا
ان سرعة التفاعل هي تغير التقدم بالنسبة للزمن و نكتب
ان تفاعل الاستر – اماهة الاستر:
- لاحرارى : لايفقد ولا يكتسب الحرارة من الوسط الخارجى
- بطىء : يحتاج لوقت طويل فى الحالة العادية للوصول الى التوازن
- غير تام : محدود و عكوس
- سرعة التقدم هى ميل المماس عند اى لحظة ونلاحظ انها تكون فى البداية كبيرة ثم تتناقص تدريجيا الى ان تنعدمحيث انعدام السرعة لا يعنى توقف التفاعل بل هناك توازن ديناميكي اى سرعة ظهور المواد فى الجهة تساوى سرعة اختفائها فى الجهة
يمكن ان نسرع التفاعل باحد الطرق التالية:
- زيادة درجة الحرارة
- استخدام وسيط مثل حمض الكبريت
- تغيير التركيز الابتد ائى للمتفاعلات
بما أن تفاعل الأسترة تفاعل عكوس يتم في اتجاهين متعاكسين ، فالتفاعل المعاكس يسمى تفاعل إماهة الأستر و هو تفاعل
للأسترة و إماهة الأستر نفس الخصائص
انجز جدول تقدم التفاعل
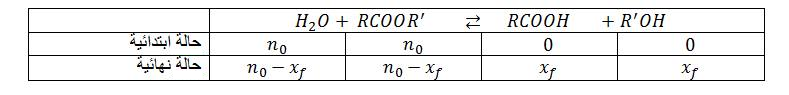
نتائج التجربة أعطت البيان التالي :
ـاحسب النسبة النهائية لتقدم التفاعل
ـناقش البيان.
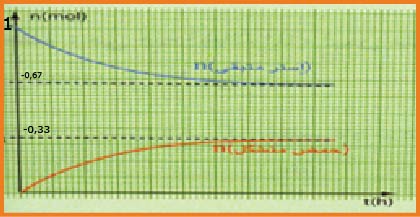
من خلال المنحنى
عند نهاية التفاعل
اذا كان التحول تاما
في حالة مزيج ابتدائي متساوي كمية المادة (متساوي عدد المولات) من الاستر و الماء فإن مردود اماهة الأستر يتعلق بصنف الكحول
- إذا كان الكحول الناتج أوليا
- إذا كان الكحول الناتج ثانويا
- إذا كان الكحول الناتج ثالثيا
وعليه
كحول أولي
كحول ثانوي
كحول تالثي
تزداد سرعة التفاعل دون تغيير المردود:
- إذا ارتفعت درجة الحرارة المزيج .
- إضافة وسيط كمثال قطرات من حمض الكبريت المركز (زيادة الشوارد ).
يزداد مردود التفاعل في الحالات التالية:
- المزيج الابتدائي غير متساوي كمية المادة .
- اجراء تفاعل الأستر بكلور الأسيل بدل الحمض الكربوكسيلي ، يجعل التحول تاما .
- حذف الأستر (أو الماء) المتشكل خلال تحول الأسترة ،يجعل التحول تاما .
لحذف الأستر المتشكل ، نضيف إلى الوسط التفاعلي محلولا لأساس قوي ، فيحدث تفاعل يسمى تفاعل التصبن (إذا كان الأستر نوعا ذهنيا نحصل على صابون ).
تفاعل التصبن : هو تفاعل تام يحدث بين الاستر ومحلول الصودا او البوتالسينمذج بالمعادلة التالية
ملح الصابون يسمى الكانوات الصديوم
من اهم الاستخدامات انها تستخدم فى صناعة الصابون
تجربة1:
نسكب المحلولين في بيشر ونغمس في المحلول الناتج صفيحة من الزنك وصفيحة من النحاس
المشاهدة:
- تتغطى صفيحة الزنك بطبقة من معدن النحاس ويزول اللون الأزرق للمحلول تدريجيا.
- يحدث التفاعل عند سطح تلامس المحلول الحاوي لشوارد النحاس ومعدن الزنك
ج-التفسير:
معادلات الاكسدة و الارجاع :
*معادلة التفاعل:
ثابت التوازن:
-قيمة كسر التفاعل للجملة في الحالة الإبتدائية
التحول الالكتروني السابق يحدث بطريقة تلقائية ( عفوية ) و مباشرة بالتماس بين الذرات
النتيجة:
*عندما نمزج أنواع كيميائية تساهم في تفاعلات أكسدة إرجاعية في محاليل مائية،
فإنه يحدث تحويل تلقائي ومباشر للإلكترونات من المرجع إلى المؤكسد.
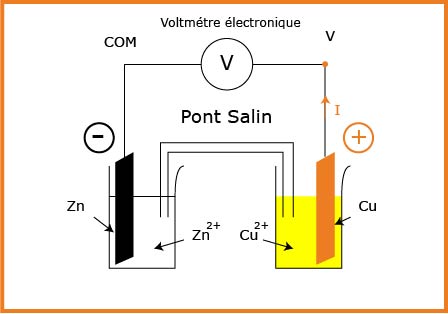
نسكب المحلول
نصل الوعائين بواسطة جسر التوصيل وهو إما أنبوب يحتوي على محلول الملحي وإما ورقة ترشيح مبلل بمحلول شاردي أو غشاء مسامي.
نصل الصفيحتين بناقل أومي على التسلسل مع مقياس الأمبير.
المخطط
الشكل المقابل
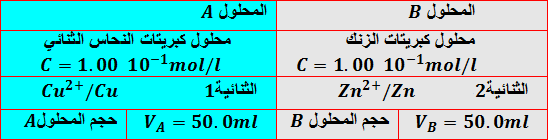
المشاهدة:
نشاهد مرور التيار من صفيحة النحاس إلى صفيحة الزنك
التفسير:
- حوامل الشحنة في المعادن وفي الغرافيت هي الإلكترونات.
- حوامل الشحنة في المحاليل الإلكترولتية هي الشوارد
- الجهة الإصطلاحية للتيار مرتبطة بجهة حركة حوامل الشحنة الموجبة.
- يمر التيار الكهربائي في الناقل الأومي من صفيحة النحاس إلى صفيحة الزنك
- يعبر التيار الكهربائي الصفائح المعدنية ،أسلاك التوصيل ،الناقل الأومي ومقياس الأمبير في الإتجاه المعاكس
- حركة الشوارد تكون في المحليل المائية.
- تتحرك الشوارد الموجبة،في نفس جهة التيار.بينما تتحرك الشوارد السالبةفي الإتجاه المعكس للتيار.
- أكسدة معدن الزنك إلى شوارد الزنك تحرر إلكترونات حسب المعادلة:
- لا يمكن للإلكترونات أن تتواجد في المحلول المائي أو أن تتراكم على الصفيحة .
- تنتقل الأإلكترونات إلى مسرى النحاس عن طريق الدارة الكهربائية.
- تستهلك الإلكترونات عند سطح تلامس معدن النحاس ومحلول كبريتات النحاس الثنائي حسب المعادلة التالية:
- حدث تبادل إلكتروني غير مباشر عن طريق الدارة الكهربائية ،نلخصه في المعادلة التالية:
عندما تكون الأنواع الكيميائية المشاركة في تفاعل أكسدة إرجاعية ،منفصلة عن بعضها ،فإنه يمكن تحقيق تحويل تلقائي وغير مباشر عن طريق ناقل معدني.وهو مبدأ إشتغال العمود.
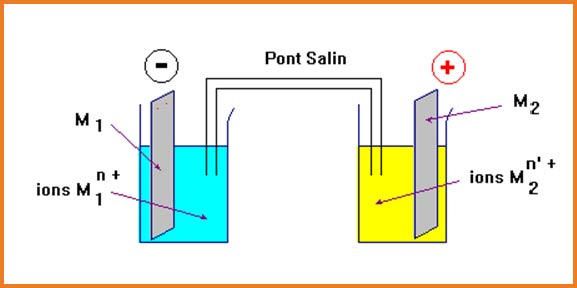
يتكون العمود من نصفين متباينين ،يحتوي كل منهما على ثنائية
يتكون نصف العمود من الصفيحة المعدنية
تسمى كدلك الصفيحة المعدنية بالمسرى وعلى سطحها يحدث تحويل الإلكترونات.
يرمز للعمود:
القطب السالب (المصعد) يكون دوما على اليسار.
مثال:
يمثل فرق الكمون بين مسريي العمود عندما لا يجري أي تيار كهربائي ،القوة المحركة الكهربائية
مثال: بالنسبة للعمود السابق:
إشتغال العمود يستنتج من قياس
في المثال السابق
نصف العمود
نصف العمود
الإعتدال الكهربائي لكل مسرى تحققه حركة الشوارد في الجسر الملحي.
كمية الكهرباء المعطاة خلال إشتغا ل العمود تساوي القيمة المطلقة للشحنة الكلية للإلكترونات المتبادلة ونكتب:
القيمة المطلقة لشحنة
كمية الكهرباء
- إختبارات
- 30
- الأجوبة الصحيحة
- False
- الأجوبة الخاطئة
- False
- مجموع النقاط
- False
المراتب الخمس الأولى في Quiz
- dark matter
- 177 نقطة
-

- Sara Abdlhafid
- 158 نقطة
-

- صلاح بشير الشريف
- 154 نقطة
-

- Ãms Ãmél
- 154 نقطة
-
- Sifodil Alaa
- 139 نقطة
-
- safaa messaoud
- 129 نقطة
-

- Prin Cesse *_*
- 109 نقطة
-

- HEM SI
- 100 نقطة
-

- nadjla selma labri
- 97 نقطة
-
- lydia zendagui
- 94 نقطة
-










