بعض المؤثرات تتحكم في حدوث و توجيه التحول الكيميائي
تحدث التفاعلات بين المواد عندما تجتمع مع بعضها ، أي يحدث التصادم بين الجزئيات، فمثلاً الصودويم المحفوظ في وعاء مغلق لا يتأثر بأوكسيجين الهواء ، ولكن لو تناولنا من الوعاء قطعة صغيرة من الصوديوم ووضعناها في صحن معرض للهواء يحدث التفاعل التالي :
التصادمات بين جزيئات الصوديوم وجزيئات الأوكسيجين ( من الهواء ) فعالة وقوية فيحدث التفاعل بشدة وقد يحدث انفجار بسيط ( حسب حجم قطعة الصودويم فكلما كانت أكبر يكون الانفجار أخطر لذلك استعمل قطعة صغيرة جداً من الصوديوم ) .
طاقة
خذ قطعة من شريط المغنيسيوم وعرضها للهواء ، ماذا تلاحظ ؟
تلاحظ أنه لا يحدث أي تفاعل ملحوظ مع أن تصادم جزيئات O2 مع جزيئات Mg الحاصلة
لا يحدث أي تفاعل ملحوظ
لماذا اختلف الأمر في حالة الصوديوم عنه في حالة المغنيسيوم مع أن كليهما تعرض للهواء تحت شروط متشابهة .
يحدث تفاعل بطيء جداً تظهر آثاره على المدى الطويل ( أسابيع وأشهر ) أما على المدى القصير ( ساعات وأيام ) فلا يظهر أي أثر للتفاعل .
أما إذا تعرضت قطعة فضة للهواء فإنّ :

لا يحدث أي تفاعل على المدى القصير والطويل ، التصادمات تحدث ولكنها ضعيفة وغير فعالة ولا تؤدي إلى حدوث أي تغيير
- حتى يحدث التفاعل بين المواد يجب أن تصطدم جزيئاتها ببعضها وإذا لم يحدث هذا التصادم فلن يحدث أي تفاعل ، فمثلاً لا يحدث أي تفاعل بين HCl ، NaOH ما دام كل منهما موضوعاً في وعاء مغلق لوحده .
- إذا حدث التصادم بين جزيئات المواد المتفاعلة فإن هذا التصادم قد يكون فعالاً ويؤدي إلى إحداث تغيير كما هو الحال مع (Na + O2 ) ، وقد يكون ضعيف الفعالية ويؤدي إلى تغير غير ملحوظ ( كما هو الحال مع Mg+O2، وقد يكون التصادم غير مؤثر وغير فعال كما هو الحال مع التصادم بين O2 ، Ag . إذن حدوث التفاعل في أمثلتنا السابقة يعتمد على طبيعة المواد المتفاعلة .
- قرصا أسبرين
- ماء ساخن
- ماء بارد
- كأسان
- ميقاتية .
- نضع في الكأس الأول ماء باردا وفي الكأس الثاني ماء ساخنا ( نفس الكمية من الماء)
- نضع في كل كأس قرص أسبرين.
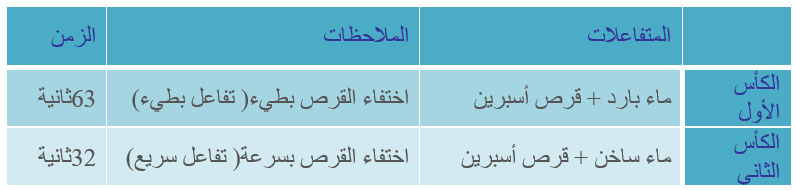
لا يخفى على الدارسين أثر درجة الحرارة على سرعة التفاعلات الكيميائية ، فعند طهي الطعام نرفع درجة الحرارة لأجل الإسراع في التفاعلات التي تؤدي إلى نضجه ، ولحفظ الطعام وإيقاف التفاعلات التي تؤدي إلى فساده وتحلله بفعل البكتيريا نضعه في ثلاجة ( برّاد) .
بعض التفاعلات الكيميائية لا يمكن أن تبدأ إلا إذا رفعت درجة حرارتها إلى حد معين ، وقد ذكرنا سابقاً أن التفاعل يحدث حينما تصطدم جزيئات المواد المتفاعلة مع بعضها تصادماً قوياً وفعالاً ويساهم رفع درجة الحرارة في ذلك . وسنوضح هذه الأفكار ببساطة من مثال معروف للدارسين هو تفاعل الهيدروجين مع الأوكسيجين لإنتاج الماء .
- الوعاء (أ) يحتوي على غاز الهيدروجين ، والوعاء (ب) يحتوي على غاز الأوكسيجين ، والوعاءان بقرب بعضهما ولكن لا يحدث تفاعل بينهما لأن جزيئات الهيدروجين لا تصطدم بجزيئات الأوكسيجين .
- نقلنا كلاً من الهيدروجين والأوكسيجين إلى وعاء جديد (ج) عند درجة حرارة المختبر (25 ْم ) إن التصادم بين جزيئاتهما يحدث الآن فهما في وعاء واحد ، ومع ذلك لا يحدث التفاعل لأن التصادمات غير فعالة . إذن قد يحدث التصادم ( التلاقي ) بين الجزيئات ولكن التفاعل لا يحدث .
- نقرب من المزيج في الوعاء (ج) عود ثقاب مشتعل يحدث التفاعل حالاً ( مع انفجار خفيف أو شديد ) .
- ينتج بخار الماء الذي يتكاثف على جدران الوعاء على شكل قطرات مائية سائلة . ينطلق عن هذا التفاعل كميات كبيرة من الطاقة .
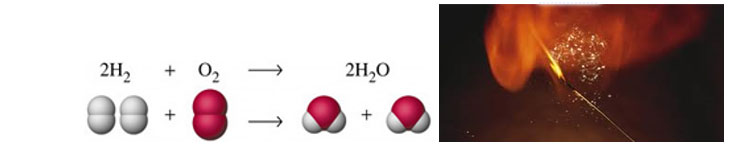
يقودنا المثال السابق عن أثر درجة الحرارة على سرعة التفاعل إلى أحد المفاهيم الكيميائية عالية الأهمية وهو مفهوم طاقة التنشيط
طاقة التنشيط : الحد الأدنى من الطاقة اللازم إعطاؤها لتفاعل ما حتى يبدأ ويستمر .
إن طاقة التنشيط تنقل جزيئات المواد المتفاعلة من حالة الخمول وقلة الفعالية إلى حالة حركية نشطة تؤدي إلى حدوث التفاعل
نستنتج أن سرعة التفاعل الكيميائي تزداد بزيادة درجة الحرارة فهي عامل مؤثر في حدوث التفاعل.
-
سكر
-
أنبوبتا اختبار
-
موقد بنزن.
-
نضع في كل أنبوبة اختبار الكمية نفسها من السكر.
-
نسخن السكر بلطف في الأنبوب الأول
-
نسخن السكر بشدة في الأنبوب الثاني.
في الأنبوب الأول يتفكك السكر حراريا متحولا إلى كراميل ( أصفر يميل إلى الاحمرار).
في الأنبوب الأول يحترق السكر متحولا إلى فحم.
تؤثر درجة الحرارة على توجيه التفاعل الكيميائي فتغير من طبيعة نواتجه.
-
عند تسخين الميثان اعتبارا من 600 درجة مئوية ينتج هباب الفحم وغاز الهيدروجين.
-
عند تسخين غاز الميثان اعتبارا من 1500درجة مئوية ينتج غاز الأستيلين C2 وغاز الهيدروجين H2.
-
كأسان
-
قرصا أسبرين
-
ماء
-
هاون
-
ميقاتية
-
ورقتان.
- نسحق قرصا في الهاون ثم نفرغه على ورقة.
- نضع القرص الثاني على الورقة الثانية.
- نضع في الكأسين الكمية نفسها من الماء.
- نفرغ في الكأس الأول ما يوجد في الورقة الأولى وفي الكأس الثاني ما يوجد في الورقة الثانية.
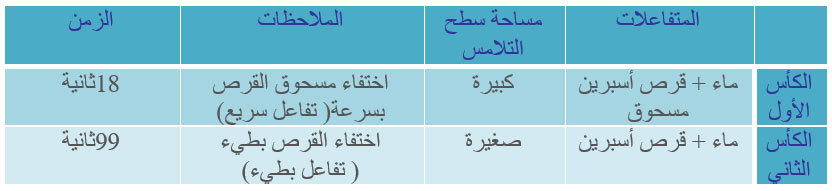
نستنتج أن سرعة التفاعل تزداد كلما كان سطح التلامس بين المتفاعلات كبيرا فهي عامل مؤثر
تكبير سطح التلامس يعني زيادة الجزيئات المتفاعلة وبالتالي زيادة سرعة التفاعل.
سبب هذه الاختلافات في السرعة هو تركيز الحمض .
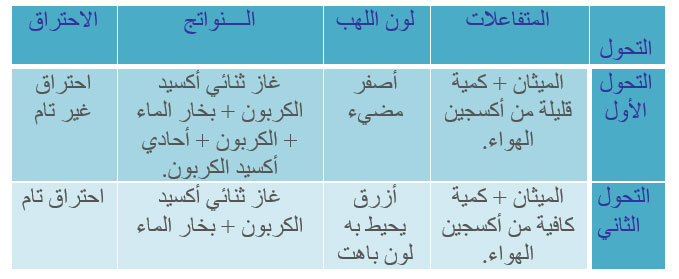
نتحكم في كمية الهواء الداخل( أن يكون الهواء متوفرا أو أقل وفرة).
نقوم بإشعال موقد بنزن ونعطي في كل حالة احتراق كمية معينة من الهواء.

-
نلاحظ أن نواتج التحول الأول تختلف عن نواتج التحول الثاني نظرا لاختلاف كمية الأكسجين في المزيج الابتدائي.
-
يلاحظ في الغالبية من التفاعلات الكيميائية أن سرعة التفاعل تبدأ عالية ثم تنخفض تدريجياً بمرور الزمن إلى أن تتوقف . والواقع أن هذا الانخفاض في السرعة يعزى إلى نقص تراكيز المواد المتفاعلة ، وهذا ما تؤكده التجارب ، فبعد أن تنخفض سرعة تفاعل ما ، يمكن أن نرفعها بسهولة إذا زدنا كمية من المواد المتفاعلة إلى وعاء التفاعل مما يؤدي إلى رفع تركيزها .
سنتطرق فيما يلي إلى مجموعة من الأمثلة نتعرف منها على أثر التركيز على سرعة التفاعل الكيميائي .
التفاعل بين فلز النحاس وحمض النيتريك HNO3 يتفاعل حمض النيتريك مع النحاس عند الدرجة °C25 ( درجة حرارة المختبر)
- تركيز الحمض 2 مول / لتر
- تركيز الحمض 3 مول / لتر
- تركيز الحمض 6 مول / لتر
عند تشابه جميع الشروط الأخرى نلاحظ أن التفاعل في التجربة الأولى يحدث ببطء شديد ، وأن التفاعل في التجربة الثانية بطيء ، ويكاد لا يختلف عن التفاعل الأول في سرعته ، أما التفاعل في التجربة الثالثة فيحدث بسرعة أكبر وتختلف اختلافاً واضحاً عن السرعة في التفاعل 1 ، 2 من الواضح أن سبب هذه الاختلافات في السرعة هو تركيز الحمض .
إن نقصان أو زيادة أحد المتفاعلات في المزيج الابتدائي يؤثر على توجيه التفـاعـل الكيميائــي فيغير من طبيعته
تتدخل بعض المواد " الغريبة " التي لا وجود لها بين المواد المتفاعلة والناتجة في تفاعل ما في سرعة هذا التفاعل زيادة أو نقصاً.وظاهرة تدخل المواد " الغريبة " في سرعة التفاعل معروفة منذ زمن بعيد ، ولكن المفهوم العلمي لها بدأ مع مطلع القرن التاسع عشر حينما لاحظ عالم روسي أن وجود حمض الكبريتيك يسرع عملية تحول النشاء إلى سكر جلوكوز :
اقترح العالم السويدي برزيليوس اسم العامل المساعد ( العامل الحفّاز ) أو الوسيط Catalyst للمادة التي تلعب دوراً شبيهاً لدور حمض الكبريتيك في مثالنا ، أما التأثيرات والعمليات التي تنتج عن تدخل العامل المساعد فتسمى الوساطة أو فعل العوامل المساعدة Catalysis . والأنزيمات في أجسام الكائنات الحية أمثلة واضحة على القدرات الخارقة للعوامل المساعدة ونشاطها الدائم
و كمثال عن العامل المساعد الأشهر والأقل كلفة هي عملية تحريك وعاء التفاعل ، إنه في كثير من الأحيان يكون عاملاً مساعداً وحيداً وله الفضل الأول والأخير في زيادة سرعة التفاعل .
مصطلح يطلق على مادة أو مجموعة مواد يؤدي وجودها ( بكميات صغيرة غالباً ) إلى تغيير في سرعة التفاعل عن طريق التدخل المباشر فيه ، ولكن عند نهاية التفاعل نسترجعها كما هي دون تغيير في خواصها الكيميائية أو كمياتها . الوسيط إذن مادة ليست غريبة عن التفاعل .
مثال :
لنأخذ التفاعل الافتراضي
يحدث هذا التفاعل ببطء شديد ولكن إذا أضفنا له قليلاً من مادة D فإن التفاعل يصبح سريعاً وتحدث الخطوات التالية :
نسمي المادة ( D ) عاملاً مساعداً ومن الملاحظ أنها تدخلت في التفاعل ولكنها في نهاية الأمر عادت إلى أصلها دون أي تغيير .
هناك عوامل أخرى تؤثر في التفاعل الكيميائي مثل الضغط، الضوء، الزمن ………
- إختبارات
- 31
- الأجوبة الصحيحة
- False
- الأجوبة الخاطئة
- False
- مجموع النقاط
- False
المراتب الخمس الأولى في Quiz
- Omar MAHMOUDI
- 360 نقطة
-

- Rokaya Rokaya
- 260 نقطة
-

- انفال مشهود
- 237 نقطة
-

- manel aguentil
- 231 نقطة
-

- marinatte lina agoulmine
- 220 نقطة
-

- douaa nadjat
- 220 نقطة
-

- Daoud Maysa
- 200 نقطة
-
- Malek Katia
- 200 نقطة
-
- sasou bhn
- 200 نقطة
-

- lamis alla
- 200 نقطة
-










