المحلول المائي - أين كتلة المذاب في المحلول
نحضر الخلائط التالية:
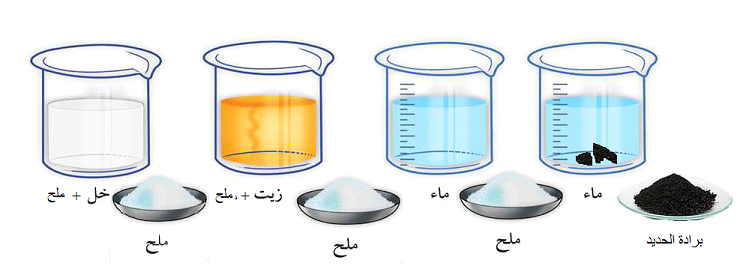
- في الوعاء الثاني نلاحظ اختفاء الملح في الماء و تكون خليط متجانس نقول إن الملح ذاب في الماء، ونسمي الملح الجسم المذاب و الماء الجسم المذيب، والخليط المحصل عليه محلولا مائيا للملح
- في الأنبوبين الأول و الثالث تكون خليط غير متجانس، نقول إن الملح غير قابل للذوبان في الزيت وبرادة الحديد غير قابلة للذوبان في الماء.
عندما تراجع مكونات المحاليل السابقة تجد أننا استخدمنا في تكوينه سائل تذوب فيه مادة
- يسمى السائل الذي استخدمته مذيبا
- و تسمى المادة التي استخدمتها مذابا
- و تسمى العملية التي تتم لتكوين المحلول عملية الذوبان
- و عندما تذوب مادة ما في مذيب ما نطلق عليها مادة قابلة للذوبان
المحلول المائي خليط سائل متجانس نحصل عليه بإذابة جسم مذاب (صلب أو سائل أو غاز) في جسم مذيب (الماء)
مذيب + مذاب
نحضر محاليل لها نفس الحجم من الماء بإذابة كميات مختلفة من السكر.
فبماذا يختلف الواحد منها عن الآخر ؟
تختلف المحاليل في درجة الحلاوة بحيث:
- في المحلول الأول ذابت كمية قليلة من السكر ويسمى بالمحلول المائي المخفف.
- في المحلول الثاني ذابت كمية كبيرة من السكر ويسمى بالمحلول المائي المركز.
تزيد درجة الحلاوة كلما زادت كمية السكر المذابة
ألأدوات:
كأس بها 150ml من الماء - كأس بها 300ml من الماء - ملعقتان سكر- ساق زجاجية
الخطوات :
- ضع ملعقة السكر و كمية 150ml من الماء في كأس، ثم ضع ملعقة السكر و كمية 300ml من الماء لتكوين المحلول السكري
- حرك كل محلول هل للمحلولين نفس درجة الحلاوة
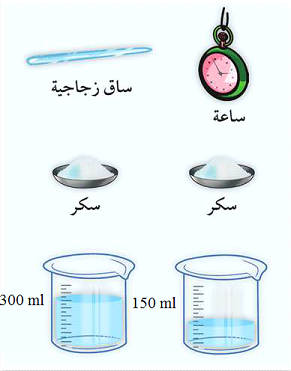
إن المحلول الأول أكثر حلاوة من الثاني من النشاطين الأول و الثاني
نستنتج أن حلاوة المحلول :
- تزيد بزيادة كتلة المادة المذابة عندما ثبتنا الحجم
- تنقص بزيادة بحجم المذيب عندما ثبتنا الكتلة
- نطلق على درجة الحلاوة أو الملوحة أوالحموضة في المحلول بتركيزالمحلول
التركيز الكتلي لمحلول مائي هو كتلة المذاب في لتر واحد من المحلول، ويرمز له بالحرف C بحيث:
وحدة التركيز الكتلي هي
عند إذابة مقدار ملعقة من السكر في كأس من الماء ، فإن الكمية تذوب بسهولة مع قليل من التحريك ، وبإضافة كمية مماثلة من السكر تستمر عملية الذوبان .
- عند إذابة مقدار ملعقة من السكر في كأس من الماء ، فإن الكمية تذوب بسهولة مع قليل من التحريك و يسمى المحلول بالمحلول المائي المخفف.
- بإضافة كمية مماثلة من السكر تستمر عملية الذوبان ، يسمى المحلول بالمحلول المائي المركز.
- المحلول الذي يمكنه إذابة مزيد من المذاب يسمى محلولاً غير مشبع .
- إذا واصلت إضافة مزيد من السكر في الماء ، فإنك ستصل إلى حد لا تستطيع أن تذيب كميات إضافية من السكر في الماء مهما بالغت في التحريك ، ويوصف المحلول في هذه الحالة بأنه مشبع .
- عند إذابة مقدار ملعقة من السكر في كأس من الماء ، فإن الكمية تذوب بسهولة مع قليل من التحريك و يسمى المحلول بالمحلول المائي الممدد
- بإضافة كمية مماثلة من السكر تستمر عملية الذوبان ، يسمى المحلول بالمحلول المائي المركز.
- إذا واصلت إضافة مزيد من السكر في الماء ، فإنك ستصل إلى حد لا تستطيع أن تذيب كميات إضافية من السكر في الماء مهما بالغت في التحريك ، ويوصف المحلول في هذه الحالة بأنه مشبع .
هل ذوبان الأجسام في المذيب يؤدي إلى تغير في كتلتها وحجمها ؟
- خذ كمية من الماء حجمها ( v1 ) و كمية قليلة من الملح كتلتها( m1 )- ضعهما في كفة الميزان حتى يتوازن، ثم سجل كتلة الماء و الملح معا .
- أمزج الآن الملح مع الماء لتحصل على محلول مائي مالح , ثم قم بوزن المحلول.
- هل تغيرت الكتلة (m) ؟ - هل تغير الحجم (v ) ؟
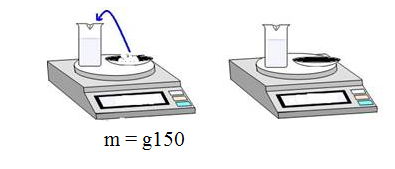
- نلاحظ أن (كتلة الماء + كتلة الملح) = كتلة المحلول المائي المالح
- نلاحظ أن حجم المحلول المائي قد تغير .( إضافة الملح ) .
خذ كمية من ماء جافيل كتلتها m1 وحجمهاv1 واضفها لكمية من الماء كتلتها m2 وحجمها v2 نقيس كتلة المحلول m .
ماذا تلاحظ؟ وماذاتستنتج ؟
الكتلة لم تتغير ولكن الحجم تغير
خلال عملية الانحلال( الذوبان ) تبقى كتلة المواد( المذيب و المذاب ) محفوظة , بينما يمكن للحجم أن يتغير.
- إختبارات
- 31
- الأجوبة الصحيحة
- False
- الأجوبة الخاطئة
- False
- مجموع النقاط
- False
المراتب الخمس الأولى في Quiz
- wassim hassad
- 334 نقطة
-

- Samia Harket
- 280 نقطة
-

- Adel Ait oufella
- 237 نقطة
-

- houda habes
- 200 نقطة
-

- Khaled Charif
- 200 نقطة
-
- سناء مناجلية
- 200 نقطة
-

- hadjer BENMEBIROUK
- 200 نقطة
-

- riad AOUAK
- 200 نقطة
-

- omar bachar
- 200 نقطة
-

- Nour manel Soltani
- 200 نقطة
-










