تطور حالة جملة كيميائية خلال تحول كيميائي نحو حالة التوازن
- _ تعريف الحمض و الأساس:(حسب برونشتد)
الحمض هو كل فرد كيميائي( شاردة أو جزيء) يحرر بروتون
الأساس هو كل فرد كيميائي( شاردة أو جزيء) يثبت بروتون
- _ تفاعل حمض – أساس :
هو تفاعل يتم بين حمض و أساس من ثنائيتين مختلفتين
الماء جسم متذبذب يمكن أن يلعب دور حمض و أساس
- أكمل الجدول
- ماذا تستنتج ؟


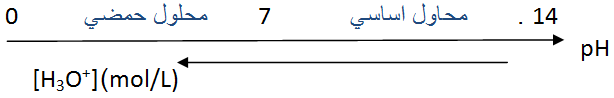
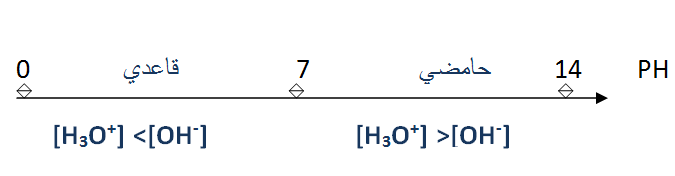
سلم ال
يزداد ال
يتناقص ال
- يستعمل ورق ال أو كاشف ملون في حالة القياس التقريبي .
- يستعمل مقياس ال متر في حالة القياس بدقة .
نقول عن
نقول عن
نقول عن
نقول عن
نحضر المحاليل التالية و التي لها نفس التركيز المولي
- محلول حمض الإيتانويك
- محلول حمض الأزوت
1- بين في كل حالة إذا كان التفاعل تاما أم محدود .
2- من بين الأحماض السابقة من هو الحمض القوي و من هو الحمض الضعيف ؟
إذا كان الحمض قوي و التفاعل تام فإن
إذا كان الحمض ضعيف و التفاعل غير تام ( محدود) فإن
محلول حمض الإيتانويك
محلول حمض الأزوت
إذن الحمض قوي و التفاعل تام
نعتبر محلولا لحمض كلور الايتانويك
- أكتب معادلة تفاعل الحمض مع الماء
- عين التقدم الأعظمي لهذا التفاعل
- عين التقدم النهائي
- عين النسبة النهائية للتقدم
1ـ معادلة تفاعل الحمض مع الماء:
2ـ تعيين التقدم الأعظمي
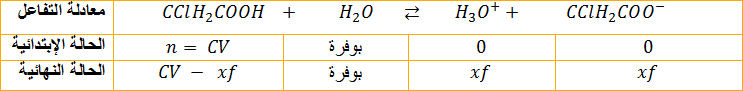
2-تحديد التقدم الأعظمي يوافق انتهاء الحمض لأن الماء بوفرة و عليه
3 ـ تعيين التقدم النهائي
من جدول التقدم
4ـ تعيين النسبة النهائية للتقدم:
هي نسبة التقدم النهائي
- ان النسبة النهائية للتقدم
- التفاعل غير تام ( محدود) : في المعادلة نستعمل
- التفاعل تام : في المعادلة نستعمل
- تتعلق
- عند تمديد المحلول أي اضافة الماء الحجم يزداد و التركيز ينقص و عليه تتزايد
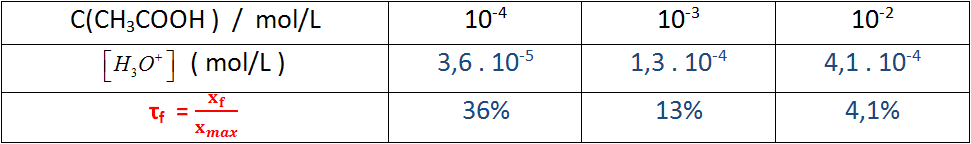
كلما كان المحلول أكثر تمديدا ، كانت النسبة النهائية لتقدم تفاعل الحمض مع الماء أكبر .
- عندما ينمذج تحول كيميائي بتفاعل يحدث في إتجاهين متعاكسين، الحالة النهائية للجملة تكون في توازن كيميائي، وهذا التوازن ديناميكي ( سرعة التفاعل متساوية في الإتجاهين).
- ليكن التفاعل الكيميائي التالي :
- نسمي كسر التفاعل :وهو مقدار يميز الجملة الكيميائية و هي في حالة ما، وهو يبيّن مدى تقدم التفاعل.
- : كسر التفاعل الإبتدائي.
- : كسر التفاعل النهائي .
في التحولات التي يكون فيها الماء هو المذيب لا يدرج
عند التوازن
اتجاه مباشر:
اتجاه عكسي:
- حضرنا محاليل لحمض الإيثانويك مختلفة التركيز ، قم بقياس ناقلية كل محلول و سجل النتائج في الجدول المعطى .
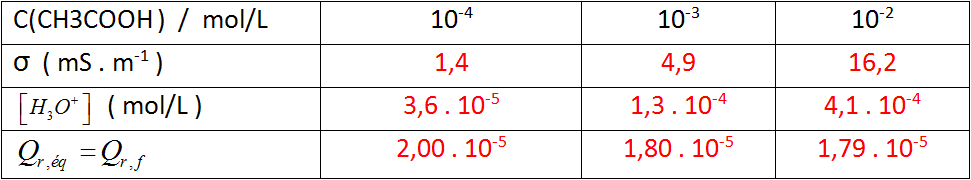
أ- أوجد عبارة
ب- بعد إجراء الحسابات قم بملأ السطر الثالث من الجدول يعطى لك :
-
2- تعطى لك عبارة كسر التفاعل في أية لحظة
أ. أوجد عبارة كسر التفاعل عند التوازن بدلالة
ب- أتمم ملأ السطر الأخير من الجدول ، ماذا تلاحظ ؟
نلاحظ أن قيمة كسر التفاعل في حالة التوازن لتحول معطى ثابتة لا تتعلق بالشروط الإبتدائية .
نعتبر حجما قدره
1- أحسب تركيز شوارد الأكسونيوم فيه .
2-كيف تفسر جود شوارد الأكسونيوم في الماء ؟ أكتب معادلة التفاعل .
يتفاعل جزيئان من الماء ، بحيث يعطي أحدهما بروتونا للآخر وفق المعادلة :
3- أتمم جدول التقدم التالي :
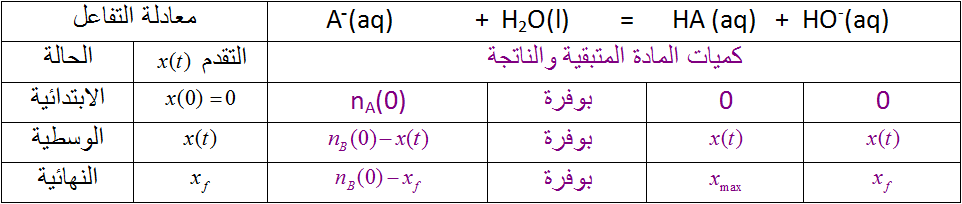
أحسب النسبة النهائية للتقدم . ماذا تلاحظ ؟ ماذا تستنتج ؟
نلاحظ أن قيمة النسبة النهائية للتقدم ضعيفة جدا ، نستنتج أن التفكك الذاتي للماء تفاعل محدود جدا .
ثابت التوازن الموافق للتفكك الشاردي للماء ( التفكك الذاتي للماء) ذو المعادلة :
يسمى الجداء الشاردي للماء يرمز له
سلم ال
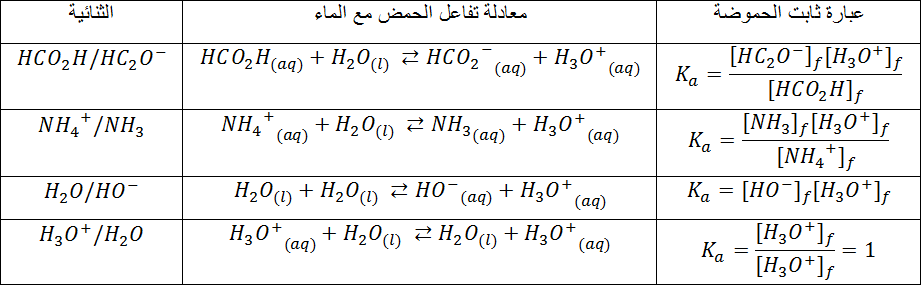
في التفاعل انحلال الحمض في الماء
نعرف ثابت الحموضة
حيث:
1- أكتب معادلة تفاعل حمض
2- ثابت التوازن المرفق لمعادلة تفاعل الحمض مع الماء يدعى ثابت الحموضة للثنائية Ka وهو معرف للثنائية ، أكتب عبارته .
3- أتمم الجدول التالي :
نقول عن حمض انه أقوى كلما حرر بروتون بسهولة أي كلما زاد تفككه في الماء .
الجدول التالي ، يعطي لك قياسات أجريت على محلولين لحمضين .
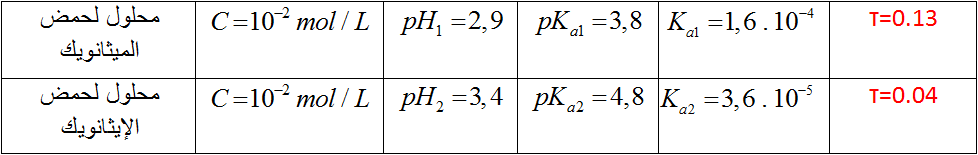
1) أكتب معادلة تفاعل كل حمض مع الماء .
2)أنجز جدول تفاعل الحمض مع الماء ، أحسب قيمة النسبة النهائية لتقدم تفاعل كل حمض مع الماء
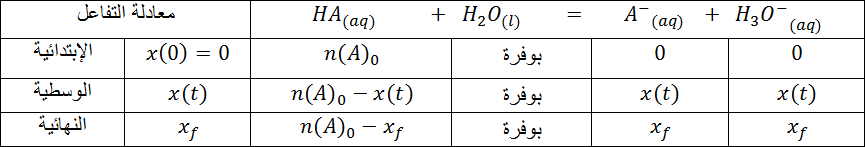
3) رتب الحمضين حسب تزايد قوتيهما . إستخلص نتيجة عامة
بما أن
نقول عن حمض أنه الأقوي إذا كانت قيمة
نقول عن أساس انه أقوى كلما إلتقط بروتون بسهولة أي كلما زاد تفككه في الماء.
الجدول التالي ، يعطي لك قياسات أجريت على محلولين لأساسين .
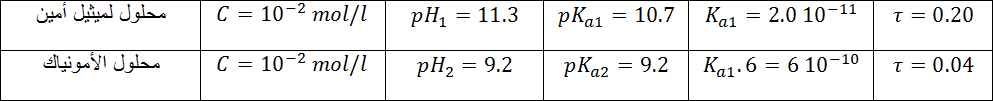
1) أكتب معادلة تفاعل كل أساس مع الماء
-
2)أنجز جدول تفاعل أساس مع ماء ، أحسب قيمة النسبة النهائية لتقدم تفاعل كل أساس مع الماء
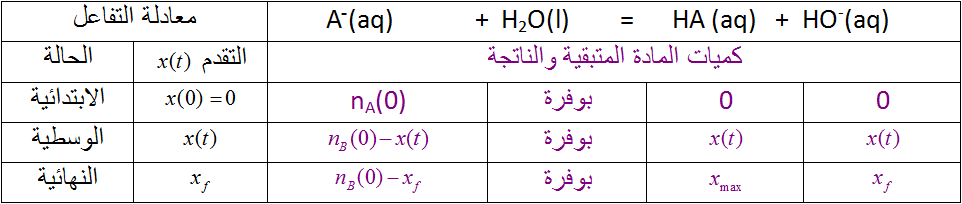
3) رتب الأساسين حسب تزايد قوتيهما . إستخلص نتيجة عامة .
بما أن فإن ميثيل أمين أقوى من الأمونياك (النشادر) .
نقول عن أساس أنه الأقوي إذا كانت قيمة
انطلاقا من عبارة
إذا كان
بأخذ لوغاريتم الطرفين نجد
و لأن :
نجد :
إذا كان
إذا كان التركيزان متساويان :
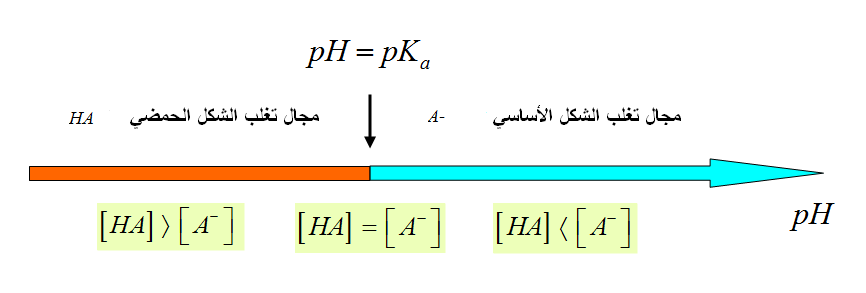
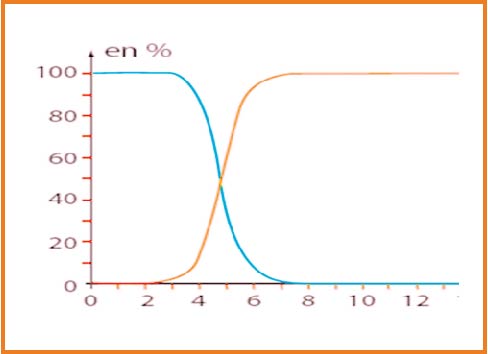
لدينا المعادلة المنمذجة لتحول الحمض و الماء
ثابت التوازن لهذا التفاعل :
بين أن
النسبة النهائية لتقدم التفاعل
منه
كذلك
منه
كلما زادت قيمة
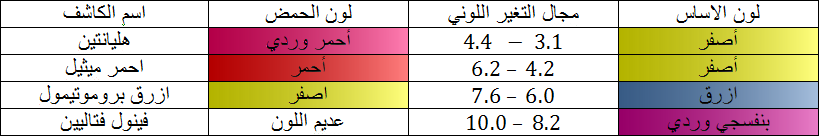
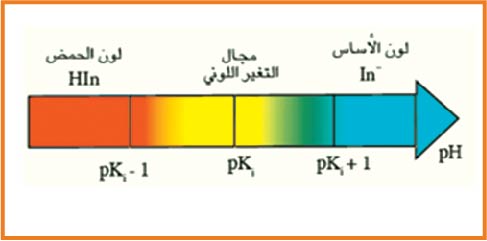
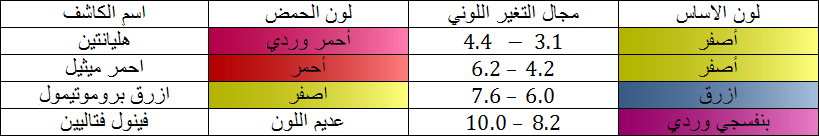
لكاشف اللوني عبارة عن ثنائية ( أساس / حمض ) حيث الصفة الحمضية و الصفة الأساسية ليس لها نفس اللون و نرمز للثنائية
حيث مجال التغير اللوني يحدد بالمجال
و ثابت الحموضة يعطى بالعلاقة :
معادلة التفاعل هي:
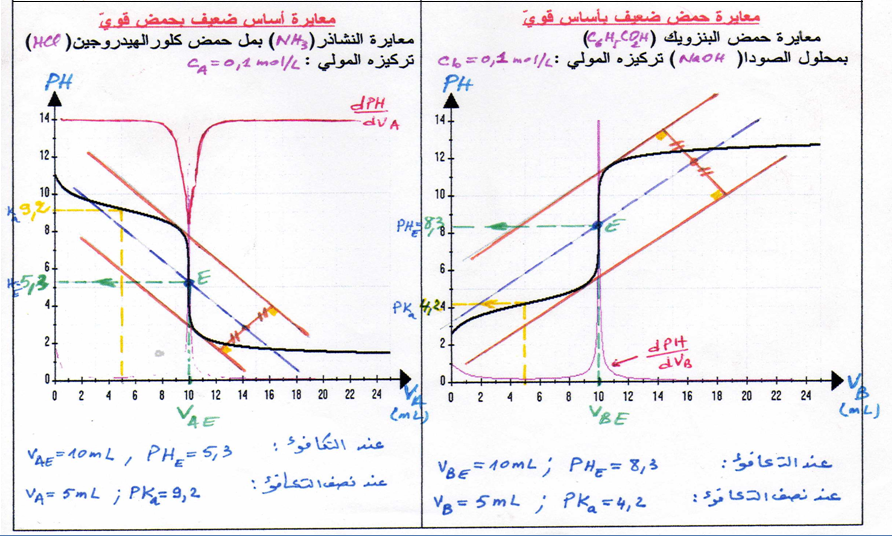
المعايرة هو دائما تفاعل ........تام
هو ايجاد تركيز مجهول لمحلول بواسطة تركيز معلوم لمحلول اخر
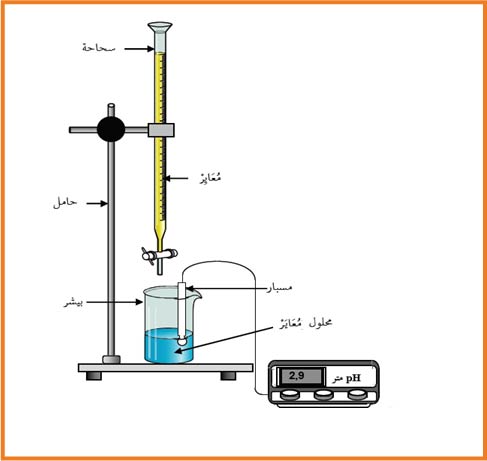
الماء المقطر . بيشر . مخلاط مغناطيسى . ماصة . سحاحة . جهاز الـ
.
أ ـ نقوم بضبط جهاز الـ
ب ـ نقوم بغسل السحاحة وبيشر بالماء المقطر
جـ ـ نثبت السحاحة فى الحامل ونضع المخلاط على القاعدة
د ـ بواسطة الماصة ناخذ حجم معين من احد المحاليل(المعايَر) ونضعه فى بيشر الذى يوضع على المخلاط
هـ ـ نضع المحلول (المعايٍر) الاخر فى السحاحة ونضبط بداية القياس
و ـ نضع مسبار الجهاز فى بيشر
ى ـ نبدا فى التسحيح قطرة تلو الأخرى ولكل حجم مسحح نقيس الـ
هي نقطة تغير الوسط حيث توافق انتهاء المتفاعلين معا أي المزيج ستوكيومتري
بحيث يكون
في حالة المعايرة حمض بأساس فان المحلول قبل التكافؤ له طبيعة المحلول المتواجد في البيشر و عليه
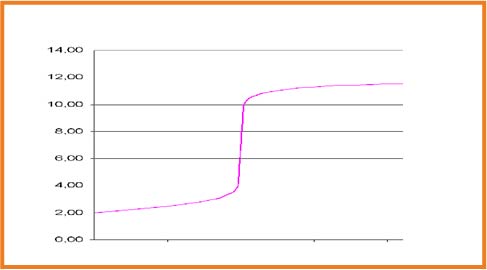
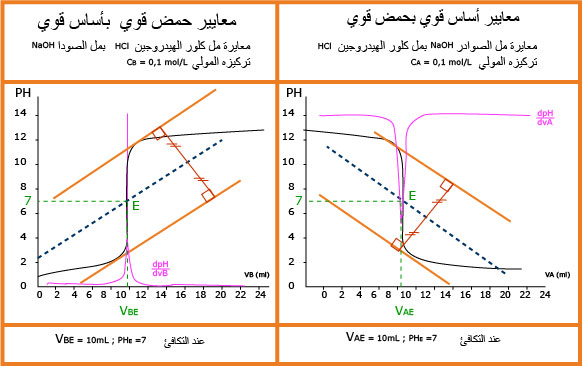
1.نرسم مماسا للبيان عند أحد الانعطافين شكل
2.نرسم مستقيما يوازي المستقيم الأول عند المنعطف الثانيشكل
3.نرسم مستقيما يوازي المستقيمين السابقين عند منتصفالخط العمودي الواصل بينهما شكل
4.تقاطع المستقيم مع البيان عي نقطة التكافؤ لها احداثيتين
-الاسقاط على محور الفواصل يحدد
- الاسقاط على محور التراتيب يحدد
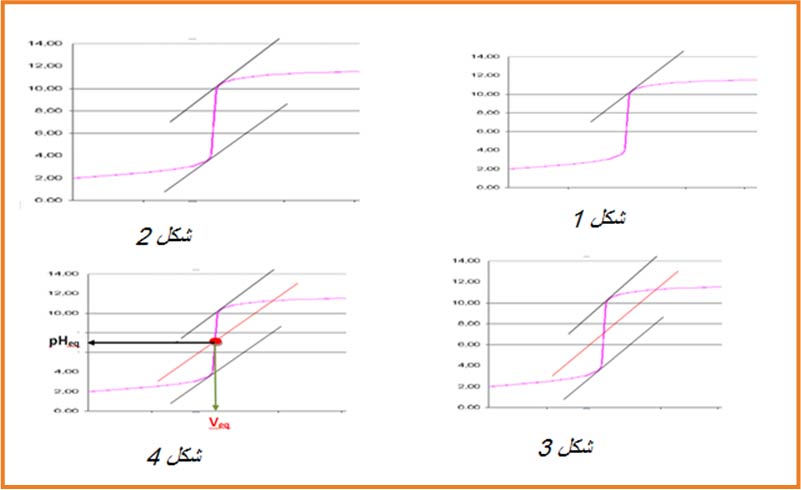
- اذا كان
- اذا كان
وعليه يمكن تحديد قيمة
1- نحدد
2- نعين القيمة على محور الفواصل .
3- نسقط القيمة على البيان ثم نحدد ترتيبتها على محو التراتيب نجد
- اذا كان
وعليه يمكن تحديد قيمة
1. قبل التكافؤ يكون تغير ال
2.عند ال يكون تغير ال
3.يكون تغير ال
4.و عليه نقطة التكافؤ توافق أكبر قيمة للتغي
نستخدم كاشف ملون حيث يكون الكاشف مناسب عندما يشمل مجال تغيره اللونى
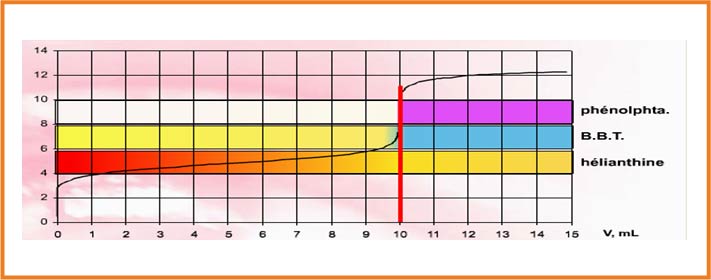
الكاشف المناسب هو الفينوفتاليين لأن
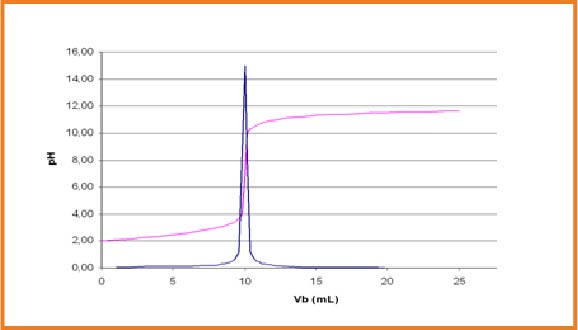
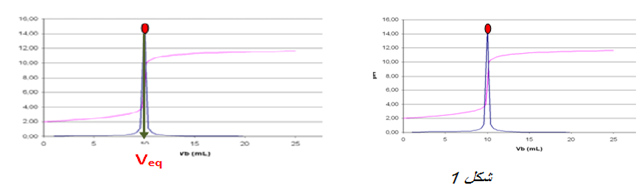
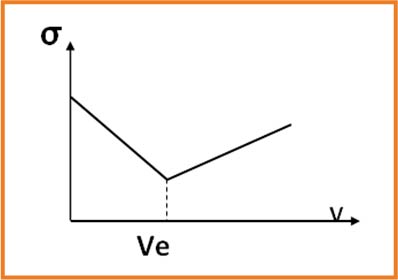
نستخدم جهاز الناقلية ثم نرسم البيان الذى يمثل تغيرات الناقلية النوعية
ان الناقلية تتعلق بتركيز الشوارد المتواجدة في المحلول في المحلول و خاصة شوارد الهيدرونيوم
1.قبل التكافؤ المحلول حامضي
2.بعد التكافؤ المحلول قاعدي
3.عند التكافؤ المزيج ستوكيومتري انتهاء المتفاعلين معا و بما أن المحلول يحتوي على شوارد متفرجة فإن الناقلية تكون عند أصغر قيمة لكن لا تنعدم و عليه نقطة التكافؤ توافق نقطة انعطاف البيان . عند الاسقط على محورالفواصل نحصل على
.
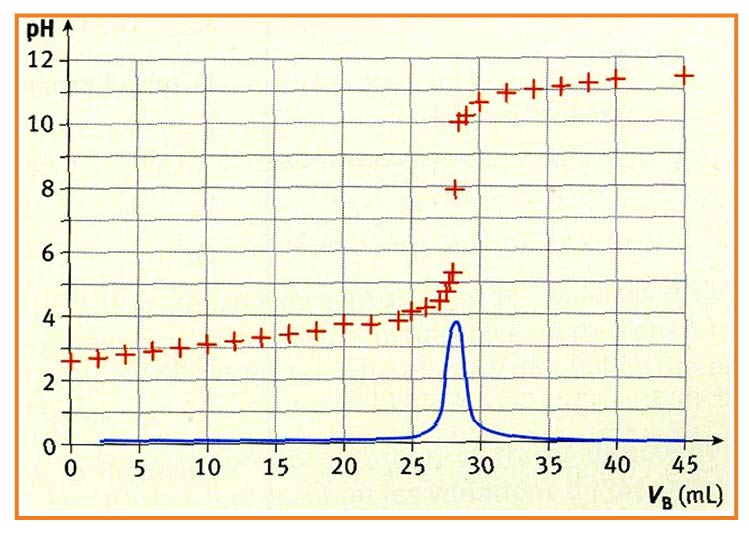
نضع في البيشر
نسجل قيمة
تطور الـ
معادلة التفاعل هي :
ــ في الجزء
ــ في الجزء
ــ في الجزء
وعند نقطة التكافؤ نجد :
ومنه نجد :
الهيليانتين هو كاشف ملون. الشكل حمض
1/ أكتب معادلة تفاعل الهيليانتين مع الماء. أعط عبارة ثابت الحموضة للثنائية
أحسب قيمته عند
2/ إن محلولا يأخذ اللون الأحمر عند إضافة بعض قطرات من الهيليانتين إذا كان
أ- عين مجال التغير اللوني للهليانتين.
ب- ما هو لون الهليانتين ؟
جـ- لماذا نضيف فقط بضع قطرات من الكاشف الملون في المحلول ؟
3/ نضيف بضع قطرات من الهيليانتين في محلول حمض كلو الماء تركيزه
1/
2/ أ-
- إذا كان
لدينا :
إذن:
- إذا كان:
نجد:
نستنتج مجال التغير اللوني للهيليانتين:
ب- نلاحظ اللون الحساس لكاشف عندما الشكلان حمض و أساس موجودان في المحلول.
ت- في هذه الحالة تركيب اللونين: أصفر + أحمر = برتقالي.
جـ- إن الكاشف له خصائص حمض-أساس، فعندما نضيف كمية كبيرة فإنّ
3/ نحسب الـ
نلاحظ أنّ
الأسبرين هو حمض الساليسيليك رمزه
نعاير محلولا من الأسبرين حجمه
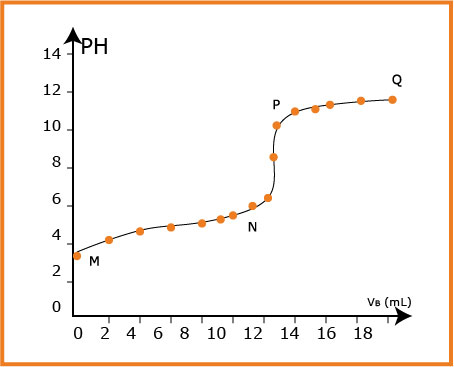
ليكن
1/ عين الأفراد المعايَرة و المعايرة.
2/ أكتب معادلة تفاعل المعايرة.
3/ حدّد منحنى المعايرة و عين خصائصه.
4/ حدّد المنحنى
5/ أعط إحداثيات نقطة التكافؤ و الطريقة المستعملة لإيجاد .
6/ ما هو الكاشف الملون المناسب.
7/ أحسب التركيز المولي .
8/ بين أنّ التحول المرافق لتفاعل المعايرة هو تام. أحسب معدل التقدم النهائي من أجل
1/ المتفاعل المعايَر هو الأسبرين، و المتفاعل المعاير هو شاردة الهيدروكسيد.
2/ المعادلة:بما أنّ التفاعل محدود، فإنّ
3/ المنحنى
- المنطقة : يتغير قليلا.
- المنطقة : يتغير بسرعة و هي المنطقة الي تحتوي على نقطة التكافؤ.
- المنطقة : يستقر.
4/ المحنى
5/ نجد
6/ نبحث عن
الكاشف الملون المستعمل هو أزرق البروموتيمول لأن
7/ عند التكافؤ يتغير المتفاعل المحد و كميات المادّة للمتفاعلات تصبح منعدمة.
بالنسبة للأساس:
بالنسبة للحمض:
نستنتج:
8/ إن
نلاحظ من المنحنى
نحسب التقدم الأعظمي:
لدينا :
لكن:
و منه :
و نعلم أنّ
نجد
- إختبارات
- 20
- الأجوبة الصحيحة
- False
- الأجوبة الخاطئة
- False
- مجموع النقاط
- False
المراتب الخمس الأولى في Quiz
- kenza azizi
- 220 نقطة
-

- Zedira Aymen
- 177 نقطة
-
- aimene LADMEK
- 174 نقطة
-

- AHMED BERGUI
- 167 نقطة
-

- Haddar Ayoub
- 157 نقطة
-
- walid lalaibia
- 150 نقطة
-

- mohamed abd el basset bendouma
- 144 نقطة
-

- عبد الحق بلخيري
- 137 نقطة
-

- MERIEM BOUHRAOUA
- 132 نقطة
-

- رانية حاجي
- 126 نقطة
-










