النشاط الأنزيمي وعلاقته ببنية الأنزيم
ما هي خصائص الأنزيم التي تمكنه من القيام بدوره ؟ وكيف يمكن قياس نشاطه ؟
- يحتوي الأنزيم على موقع فعال ترتبط به مادة التفاعل
- نقيس نشاطه بالتجارب بإضافة الأنزيم أو عدم إضافته أوبزيادة تركيز مادة التفاعل.
تستطيع خلايا الخميرة (فطر أحادي الخلية ) النمو والتكاثر في وسط يحتوي على السكروز عن طربق إفراز أنزيم إلى الخارج يقوم بإماهة السكروزإلى الغلوكوز وفراكتوز ، تقوم الخميرة بإمتصاص السكريات الناتجة عن الإماهة لإستعمالها كمصدر للطاقة لإثبات وجود النشاط الأنزيمي في الوسط الذي تنمو فيه الخميرة نقوم بإجراء التجربة التالية :
 - محلول الخميرة (100 غ / لتر ماء) محضر قبل إجراء التجربة
- محلول الخميرة (100 غ / لتر ماء) محضر قبل إجراء التجربة
- 20 مل محلول السكروز 0,1 مول / ل يوزع على 4 أنابيب مختلفة :
الأنبوب الأول : 2 مل من محلول السكروز فقط
الأنبوب الثاني : 2 مل من محلول السكروز + 2 مل من محلول الخميرة
الأنبوب الثالث : 2 مل من محلول السكروز + 2 مل من راشح محلول الخميرة
الأنبوب الرابع : 2 مل من محلول السكروز + 2 مل من راشح محلول الخميرة تسخينه لدرجة الغليان .
توضع الأنابيب الأربعة في حمام مائي عند 30 درجة مئوية تقريبا ، نقوم بالكشف عن وجود الغلوكوز في المحلول بعد مرور فترات زمنية مختلفة ، نتائج التجربة موضحة في الجدول
- كما لوحظ أن ترك الأنبوب 1 لفترة طويلة (عدة أشهر ) يؤدي إلى إماهة كاملة للسكروز.
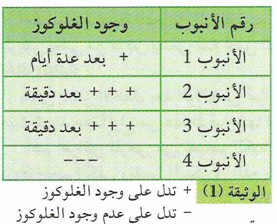
ماذا تستخلص من مقارنة النتائج التجريبية في الأنبوبين 1 و 2 .
وجود الغلوكوز في الأنبوب (2) بكمية أكثر وأسرع من الأنبوب (1) نستخلص ان وجود الخميرة أدى إلى تسريع إماهة السكروز مما يدل على أن الخميرة تفرز جزيئات تسرع التفاعلات .
ما هي المعلومات الإضافية المستخلصة من نتائج الأنبوبين (3) ، (4) ؟
من نتائج الئانبوبين (3)، (4) تبين أن المادة التي سرعت التفاعل هي جزيئات قابلة للترشيح وهي تخرب بالحرارة مما يشير أنها ذات طبيعة بروتينية .
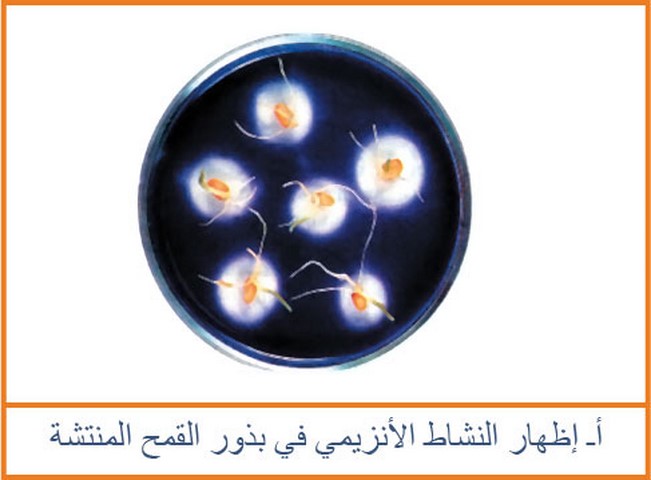
يتم ملأ طبق بتري بمادة الجيلوز الممزوجة بالنشاء يتم قطع بذور القمح في طور الإنتاش إلى نصفين طوليا ثم توضع على طبقة الجيلوز (الوجه المقطوع إلى الأسفل) كما في الوثيقة بعد عدة أيام يتم سكب محلول اليود على طبقة الجيلوز
نتائج الإختبار موضحة في الوثيقة (2) .
يتم نزع الجيلوزالموجود على تماس والقريب من نصف البذرة ووضعه في أنبوبة إختبار ثم تتم إضافة محلول فهلنج مع التسخين فيلاحظ ظهور راسب أحمر آجوري .
يتم سحق بذور القمح في طور الإنتاش في ماء مقطر يترك الخليط لمدة 30 دقيقة ثم يرشح في أنبوب إختبار يضاف حجم من الراشح إلى محلول النشاء بعد عدة دقائق يتم إضافة محلول اليود فلا يلاحظ وجود اللون الأزرق البنفسجي.
علل عدم تلون المناطق القريبة من نصف البذرة بالون الأزرق البنفسجي في المرحلة الأولى .
يعود عدم تلون المناطق القريبة من نصف البذرة باللون الأزرق لغياب النشاء الذي حدثت له إماهة أو تفكك .
فسر نتائج المرحلتين 1 و 2 .
تفسر نتائج المرحلتين (1) و (2) بإماهة النشاء بواسطة أنزيمات ثم إفرازها من طرف البذرة و إنتشرت إلى المناطق المجاورة التي حولت النشاء إلى سكريات بسيطة وهذا مما يؤكده ظهور راسب أحمر آجوري .
ماذا تستخلص من نتائج المرحلة 3؟
نستخلص من نتائج هذه التجربة أن المسؤول عن إماهة النشاء هو جزيئات قابلة للترشيح و هذا ما يؤكد ما تم التوصل إليه في المرحلة الثالثة و أن هذه الجزيئات عبارة عن أنزيمات .
في هذه الحالة يتم الإستعانة بتركيب تجريبي مرتبط بالحاسوب ، يضم التركيب التجريبي عادة المكونات الموضحة في الوثيقة (3 ) (يختلف شكل وعدد المكونات حسب الشركة المنتجة وحسب إحتياجات التجربة ) .

- المفاعل الحيوي (Bioréacteur) : و هو الجزء الذي يتم فيه التفاعل وتتم فيه القياسات ويحتوي على وعاء لإجراء التفاعل توضع فيه المحاليل والمواد المتفاعلة والأنزيم يزود الوعاء بمكان لحقن المواد المراد إضافتها للتفاعل مثل الأنزيم أو مواد التفاعل أو مواد تؤثر على التفاعل وغيرها ، يكون الوعاء عادة محكم الغلق خاصة في التفاعلات التي يتم فيها قياس تركيز الغازات (الأكسجين أو ثاني أكسيد الكربون )
- مسبار أو لاقط Capteur (Sonde): يمكنه الكشف عن مادة معينة في الوعاء وقياس تركيزها بصورة مستمرة ، لذلك يختلف نوع اللاقط حسب نوع التفاعل المراد إجراؤه ونوع المواد المتفاعلة أو الناتجة المراد قياسها وقد يستعمل لاقط آخر أو لاقطين أحدهما خاص بالحرارة والآخر خاص بدرجة الحموضة PH وذلك بمتابعة تغيراتها أثناء حدوث التفاعل
- وسائط Interfaces لربط اللاقط أو اللواقط بالحاسوب
- حاسوب مزود ببرنامج خاص Logiciel يسمح بحساب وعرض النتائج على شاشة الحاسوب على شكل منحنيات.
بإستغلال المعطيات السابقة والمفيدة ، حدد مميزات التجارب العادية مقارنة بإستعمال EXAO
- يسمح بالقياس السريع للمواد المتفاعلة أو النواتج بدقة
- يسمح لنا بمتابعة سير التفاعل على شاشة الحاسوب بصورة لحظية (آنية) ، لاننتظهر إنتهاء التجربة للحصول على النتائج .
- يسمح لنا بمشاهدة تأثير إضافة مركبات أوتغيرات في شروط التفاعل المباشر
- يسمح بالحفاظ على النتائج في ذاكرة الحاسوب للرجوع إليها في أي وقت ومقارنتها مع النتائج الأخرى كما يمكن إجراء رسم للمنحنى في نفس المعلم للتجربة السابقة لغرض المقارنة .
يتطلب التفاعل أثناء إستعمال EXAO متابعة تغيرات PH الوسط ودرجة الحرارة . علل إجابتك ؟
تغيرات كل من PH والحرارة تؤثر على النتائج المنتظرة لأن الأنزيمات من طبيعة بروتينية ولها بنية فراغية محددة ودرجة الـ PH تغير من نوع الروابط بتغيرها مما يفقد الأنزيم البنية الفراغية و بالتالي موقعه الوظيفي فيتوقف النشاط الأنزيمي ونفس الشيء بالنسبة لدرجة الحرارة.
لدراسة حركية التفاعلات الأنزيمية وقع الإختيار على أنزيم غلوكوز أكسيداز ( Glucose Oxydase GO) كمثال للدراسة يقوم هذا الأنزيم كوسيط لتنشيط التفاعل التالي :
وقع الإختيار على هذا الأنزيم نظرا لإمكانية متابعة هذا التفاعل عن طريق التجريب المدعم بالحاسوب بإستعمال لاقط الـ
يمكننا إختيار أنزيم Catalase لنفس الغرض ، حيث يقوم هذا الأنزيم بتحفيز التفاعل التالي:
بإستعمال غلوكوز أوكسيداز GO تم إجراء سلسلة من التجارب عن طريق الـ EXAO كما يلي:
دراسة تغيرات تركيز الأكسجين بدلالة الزمن في غياب وفي وجود الأنزيم
تمت الدراسة بإستعمال محلول غلوكوزي (مادة التفاعل) بتركيز محدد وفي درجة حرارة ثابتة (37 درجة مئوية ) وعند درجة PH ثابتة (7) بعد وضع عناصر التفاعل في المفاعل يتم تشغيل التركيب التجريبي ويبدأالتسجيل على شاشة الحاسوب بعد تشغيل البرنامج عند ز = 30 ثانية من إنطلاق التسجيل يتم حقن تركيز ثابت من الأنزيم GO ، يتم إجراء نفس التجربة السابقة بدون حقن للأنزيم النتائج المحصل عليها ممثلة في الوثيقة (4) .
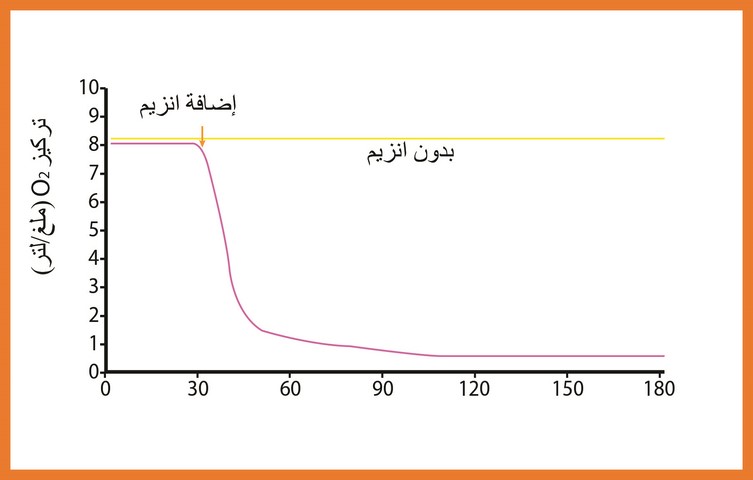
حلل ثم فسر المنحنيين إعتمادا على معادلة التفاعل 1 .
عند إضافة الأنزيم يتناقص تركيز الـ
إستنتج دور الأنزيم في التفاعل .
دور الأنزيم في التفاعل تحفيز إستهلاك
دراسة تغيرات تركيز الأكسجين بدلالة الزمن ، بعد حقن كمية صغيرة من مادة التفاعل (الغلوكوز) بإستعمال تركيز محدد من الأنزيم وفي درجة حرارة ثايتة (37 درجة مئوية ) وعند درجة PH = 7 تم حقن كمية متساوية من الغلوكوز عند الزمنين ز 1 و ز 2 النتائج ممثلة في الوثيقة (5)
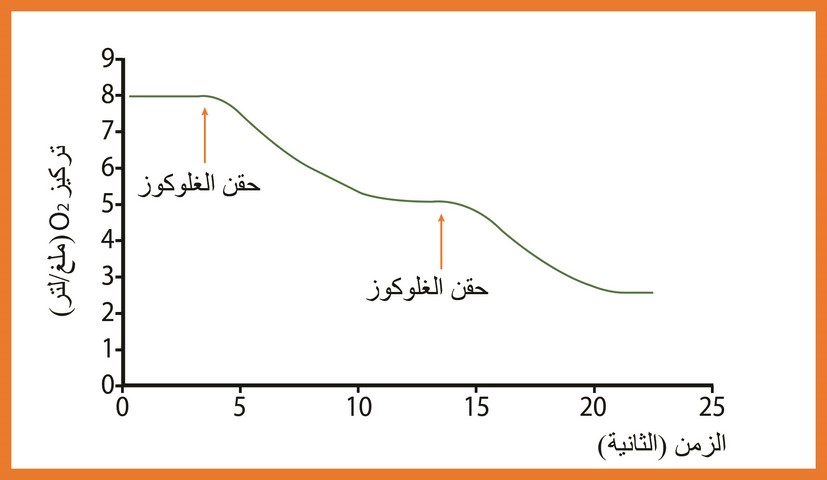
حلل وفسر المنحنى بعد الحقن الثاني .
بعد الحقن الثاني ينخفض الـ
ما هي المعلومة الإضافية التي يمكن إستنتاجها حول عمل الأنزيم ؟
الإجابة الأنزيم لايستهلك أثناء التفاعل أي يبقى على حاله في نهاية التفاعل .
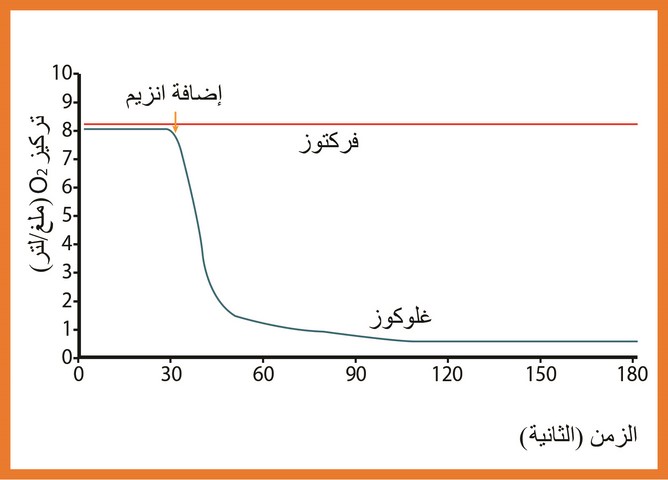
دراسة تغيرات تركيز الأكسجين بدلالة الزمن في وجود الغلوكوز ، أنجزت في هذه المرحلة تجربتين تم في كل منهما قياس تغيرات تركيز الأكسجين في وسط التفاعل المحتوي على تركيز ثابت من الأنزيم GO بالإضافة إلى سكر الغلوكوز أو الفراكتوز في درجة حرارة ثابتة (37 درجة مئوية ) وعند درجة PH ثابتة (7) النتائج ممثلة في الوثيقة (7).
فسر عدم إستهلاك
نفسر عدم إستهلاك
نستنتج أن علاقة الأنزيم بمادة التفاعل نوعية أي كل أنزيم متخصص على نوع واحد من مادة التفاعل
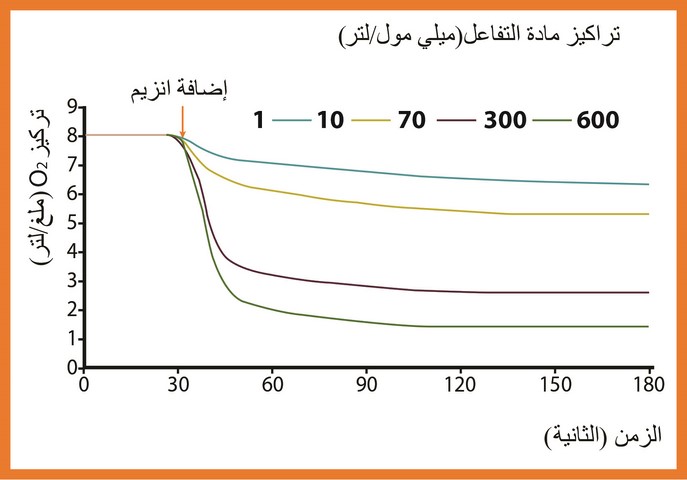
دراسة تغيرات السرعة الإبتدائية للتفاعل الأنزيمي (VI : Vitesse Initiale ) بدلالة تركيز مادة التفاعل ( الغلوكوز في كل تجربة 1،10،70،300،600) ميلي مول من S / لتر . تم إجراء التجارب الخمسة عند نفس درجة الحرارة (37درجة مئوية ) وعند نفس الـ (7 = PH) نتائج التجارب الخمسة ممثلة في منحنيات الوثيقة (6) كما يوضح الجدول (1) قيم السرعة الإبتدائية التي تم إستخراجها من معطيات الوثيقة (6).
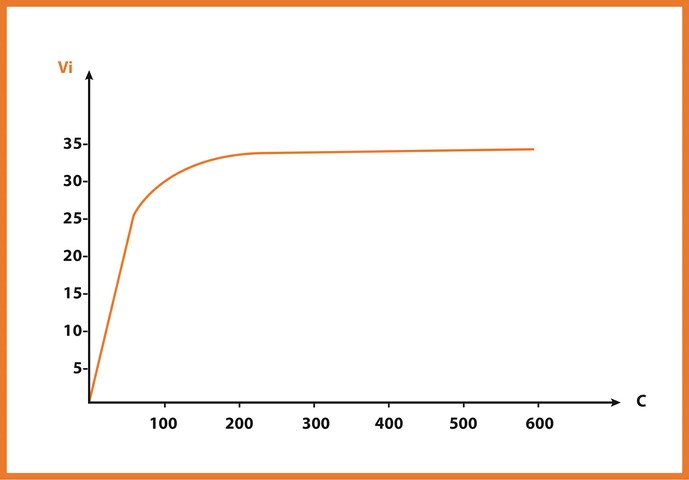
أرسم منحنى تغيرات السرعة للتفاعل بدلالة تركيز مادة التفاعل بإستعمال المعطيات في الجدول (1) ، حلل المنحنى الناتج وماذا تستنتج؟
تزداد سرعة التفاعل الأنزيمي بزيادة تركيز مادة التفاعل إلى أن يصل إلى التركيز 300 بحيث تصبح ثابتة مهما زاد تركيز مادة التفاعل .
تزداد سرعة التفاعل الأنزيمي بزيادة تركيز مادة التفاعل إلى أن يصل إلى التركيز 300 بحيث تصبح ثابتة مهما زاد تركيز مادة التفاعل .
نستنتج أن سرعة التفاعل الأنزيمي تثبت عند التراكيز العالية لمادة التفاعل .
إقترح فرضية أو فرضيات لتعليل تغيرات سرعة التفاعل الأنزيمي في التراكيز المرتفعة لمادة التفاعل .
تتمثل في تشبع الأنزيم بمادة التفاعل أي أن الأنزيم قد بلغ طاقته القصوى ولم يعد قادرا على تحويل كميات أكبر من مادة التفاعل وعدم وجود أنزيم في الوسط .
تم عن طريق برنامج راستوب تمثيل البنية الفراغية لأنزيم الليزوزيم E في غياب مادة التفاعل وفي وجودها ES فتحصلنا على النماذج الجزيئية الموضحة في الوثيقة (8).
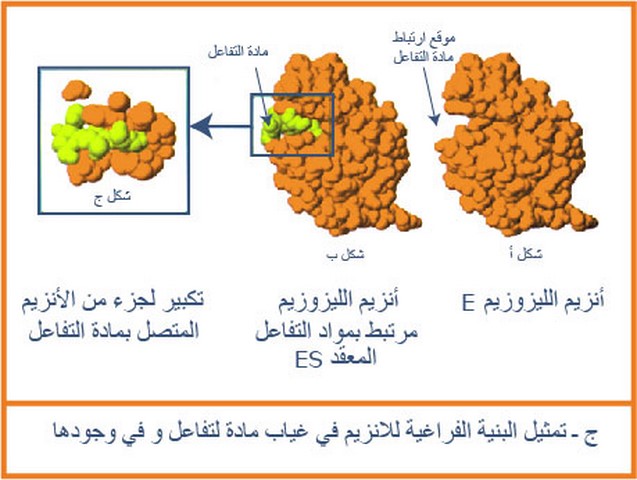
ماذا تستنتج فيما يخص العلاقة بين البنية الفراغية للأنزيم ومادة التفاعل إنطلاقا من الشكلين (ب)و(ج) من الوثيقة (8).
هناك علاقة تكامل في الشكل الفراغي بين مادة التفاعل وجزء صغير من الأنزيم كالتكامل بين القفل والمفتاح .
ما هي العلاقة بين أشكال الوثيقة (8) وثبات سرعة التفاعل في التراكيز العالية لمادة التفاعل في التجربة ؟
هناك عدد محدد من مواقع الإرتباط عند تشبعها تصل سرعة التفاعل الأنزيمي إلى أقصاها وهذا ما يؤكد الفرضية السابقة .
إقترح تسمية لموقع إرتباط مادة التفاعل مع الأنزيم .
الموقع الفعال .
لتوضيح أكثر للعلاقة بين الأنزيم ومادة التفاعل في الحالات المختلفة نقترح الأشكال الموضحة في الوثيقة (9).
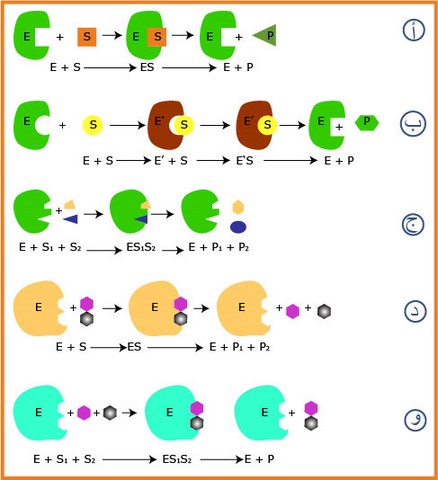
قارن شكل الأنزيم ومادة التفاعل في الشكلين (أ)، (ب) من الوثيقة (9) قبل وبعد الإرتباط ، ماذا تستنتج ؟
هناك إختلاف في الشكلين (أ) و (ب) حيث شكل الموقع الفعال ومادة التفاعل متكامل في (أ) قبل وبعد الإرتباط ، أما في الحالة (ب) فهو غير متكامل قبل الإرتباط ومتكامل بعده ، نستنتج أن التكامل بينهما بينهما ضروري لحدوث التفاعل حيث في بعض الأنزيمات يكون هذا التكامل موجود في وجود وفي غياب مادة التفاعل ، بينما يتم التكامل في بعض الأنزيمات فقط عند إقتراب مادة التفاعل التي تحفز الأنزيم لتغيير شكلموقعه الفعال ، تسمى هذه الصورة بالتكامل المحفز .
بالإعتماد على نواتج التفاعلات لكل أنزيم ، حدد نوع التفاعل الذي يقوم به الأنزيم في الحالات (ج)، (د)،(و) ز ما نوع التفاعل الذي ينتمي إليه أنزيم GO و Catalase ؟ علل ذلك.
(أ): تحويلي
(د): تفكيكي
(و): تركيبي
- نوع تفاعل GO و Catalase تفكيكي لتشكيل مادتين في نهاية التفاعل (المعادلات موضحة ص 63 )
- إختبارات
- 10
- الأجوبة الصحيحة
- False
- الأجوبة الخاطئة
- False
- مجموع النقاط
- False
المراتب الخمس الأولى في Quiz
- rami razi
- 263 نقطة
-

- amani benlouanas
- 243 نقطة
-

- anis messai
- 217 نقطة
-

- amani touati
- 203 نقطة
-

- SA RA
- 197 نقطة
-

- بشرى ياسمين معطي
- 197 نقطة
-

- ملاك ملاك
- 183 نقطة
-

- malika chaouch
- 183 نقطة
-

- عبد المؤمن شداد
- 183 نقطة
-

- Chou Chou
- 183 نقطة
-










