التحليل الكهربائي البسيط
تتكون الذرة من نواة مركزية تجمع بين جميع الشحنات الموجبة . حول هذه النواة تتحرك الإلكترونات ، كل منها يحتوي على شحنة سالبة واحد.
في المعادن ، الذرات مكدسة بشكل منتظم.هذا ما يسمح لبعض الإلكترونات بالقفز من ذرة إلى أخرى .
عادة الإلكترونات تتحرك بشكل عشوائي (شكل 1) لكن عندما تعرض ل الجهد ،تتحرك جميع الإلكترونات في الاتجاه نفسه أي
نحو القطب "+" من المولد (شكل 2) فتشكل حركة الالكترونات هذه التيار الكهربائي .
تدفق الالكترونات في الاتجاه المعاكس للاتجاه الاصطلاحي للتيار
الأدوات المستعمل: مولد التيار المستمر،الأنبوب
في الجزء العلوي من الأنبوب يوجد محلول لحمض الكبريت العديم اللون في الجزء السفلي المحلول ذو اللون الأخضر عبارة عن خليط من كبريتات النحاس
الثنائية
كل الشوارد في المحلول عديمة اللون ما عدا:
شاردة النحاس
شاردة ثنائي الكرومات
بعد دقائق نلاحظ ظهور حلقتان ملونتان في نهاية الانبوب( الصورة المقابلة)
حلقة زرقاء في جهة الالكترود السالب: دليل على هجرة شوارد النحاس
حلقة برتقالية في جهة الاكترود الموجب: دليل على هجرة شوارد الكرومات
هذه التجربة تبرهن على الهجرة المزدوجة للشوارد في المحلول عندما نمرر
خلالها تيارا كهربائيا
- الشحن الموجبة نحو الإلكترود السالب (المهبط )
- الشحن السالبة نحو الإلكترود الموجب (المصعد)
علما بأن الأيونات الشوارد تنجذب إلى الأقطاب المعاكسة لها في الشحنة .
ولكن ماذا يحدث للأيونات عندما تصل للأقطاب ؟
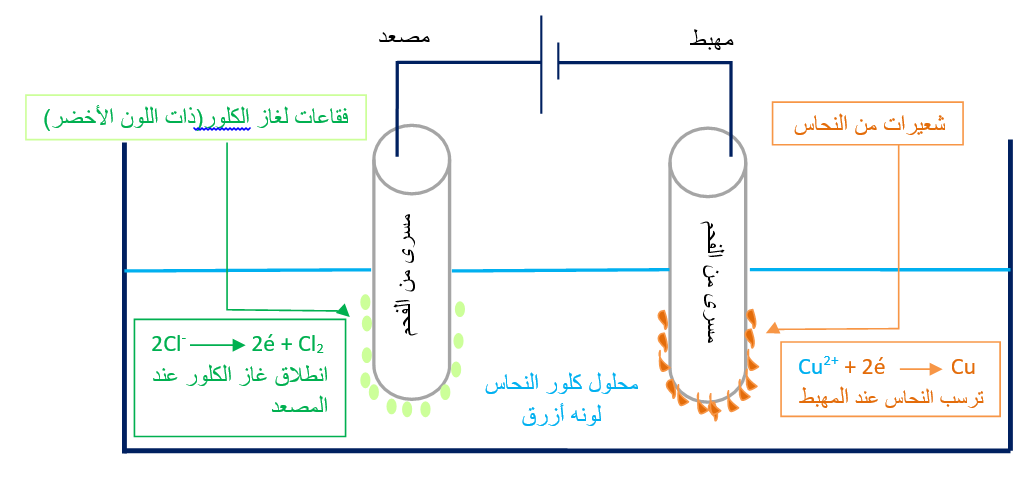
تجربة تحليل كلور النحاس
رتب الجهاز المجاور :
وعاء تحليل- الكترودين - مولد للتيار - محلول كلور النحاس
تجرى التجربة في خزانة الأبخرة أو غرفة ذات تهوية جيدة .
لاحظ ما يحدث على كل قطب .
اختبر الغاز الناتج على القطب الموجب بواسطة ورقة عباد الشمس
- ماذا حدث لورقة عباد الشمس ؟
- ما الغاز المتصاعد ؟
- ارفع القطب السالب من الدورق ؟
- صف المادة الموجودة على القطب ؟
- ما المادة المترسبة على القطب باعتقادك؟
تحلل كلوريد النحاس كهربائياً ونتج عن ذلك :
ترسب معدن النحاس عند القطب السالب ( مهبط ).
تصاعد غاز الكلور عند القطب الموجب ( مصعد ).
لذلك نقول أن الكهرباء قد حولت كلوريد النحاس إلى عنصري النحاس والكلور .
انظر إلى الشكل المجاور :
يعمل التحليل الكهربائي كالبنك، تمثل فيه الأيونات الزبائن ،
بينما تمثل الإلكترونات النقود.
• يتم تبادل الإلكترونات بين البطارية والأقطاب، ولايمكن أن تنتقل بين الأقطاب.
• تغادر الإلكترونات القطب السالب من البطارية وتهبط على المهبط ، وتكتسب الأيونات الموجبة
ما يكفيها من الإلكترونات .
• تفقد الأيونات السالبة الفائض من الكتروناتها عند المصعد ، وتصعد على أثرها إلى البطارية ،
وبذلك تكون الدارة الكهربائية قد اكتملت .
وعلى جميع الأحوال لا تنتقل الإلكترونات بين الأقطاب .
يمكننا وصف ما يحدث على كل قطب باستخدام أنصاف التفاعل .
تبين لك أنصاف التفاعل ما يحدث لكل أيون على كل قطب .
لنعد إلى عملية التحليل الكهربائي لكلوريد النحاس :
أيون النحاس يحمل شحنة (+2) . وهذا يعني أنه بحاجة لإلكترونين للتعادل .
يمكن أن يحدث ذلك على القطب السالب ( المهبط ) ،
ويمكن تمثيل ما يحدث على المهبط بواسطة نصف التفاعل الآتي :
على القطب الموجب ( المصعد ) ، يفقد أيون الكلور Cl- الكترونه الزائد وتتكون ذرة كلور متعادلة:
ولكن الكلور لا يوجد على شكل ذرات
وإنما على شكل جزيئات
لذلك تتحد ذرتا كلور لتكوين ذلك الجزيء في الحالة الغازية
تعلمنا أن التحليل الكهربائي يستخدم لاستخلاص
العناصر النشطة ، مثل الألومونيوم .
لاحظنا أيضاً أن أقطاب الكربون لم تشارك في التحليل الكهربائي ، وانحصر دورها في نقل الالكترونات وعليه فهي تسمى أقطاب خاملة ، و يسمى التحليل الكهربائي بالبسيط
ولكن هنالك أقطاب تشارك في التحليل وتسمى الأقطاب النشطة .
من الأمثلة على الأقطاب النشطة ، قطب النحاس، النيكل، الفضة
انظر إلى المقارنة الآتية بين عمليتي التحليل الكهربائي لمحلول كبريتات النحاس باستخدام أقطاب كربون في الأولى وأقطاب نحاس في الثانية
مصعد النحاس قطب نشط .
عندما تتكون ذرات نحاس على المهبط ، تفقد ذرات نحاس عند المصعد .
عندما تغادر أيونات النحاس المحلول عند المهبط تتكون ذرات نحاس عند المصعد . تجعل أيونات النحاس
- إختبارات
- 26
- الأجوبة الصحيحة
- False
- الأجوبة الخاطئة
- False
- مجموع النقاط
- False
المراتب الخمس الأولى في Quiz
- Bellil Isslam
- 240 نقطة
-
- mlk cheonsa
- 220 نقطة
-

- KAMEL MIMOUN
- 220 نقطة
-

- apk chamsou
- 220 نقطة
-

- Santfreche Lilya
- 200 نقطة
-
- lotfi hadjsadok
- 200 نقطة
-

- rayane rayane
- 200 نقطة
-

- Achref Boudhene
- 200 نقطة
-

- Iem Mer
- 191 نقطة
-
- Dôü Dâ
- 190 نقطة
-









