التفاعلات الكيميائية في المحاليل الشاردية
نحظر محلولا لحمض كلور الماء وذلك باظافة كمية قليلة من حمض الكلور الى لتر من الماء
نعلم من الدرس السابق أن حمض الكلور سينحل في الماء معطيا شاردة الهيدرونيوم
نأخذ كمية قليلة من المحلول نضعها في أنبوب اختبار ونضيف لها صوف الحديد
نلاحظ انطلاق فقاعات غازية واختفاء تدريجي لبرادة الحديد نضع غطاء بالمقلوب بكيفية نحتفظ فيها بالغاز المنطلق ونتفادى ارتفاع الضغط داخل الأنبوب
ننتظر عشر دقائق حتى نحصل على كمية معتبرة من الغاز ثم ننزع الغطاء و بسرعة نقرب عود ثقاب مشتعل
عندما نقرب من الغاز المنطلق عود ثقاب مشتعل نسمع له فرقعة وهذا دليل على أن هذا الغاز هو الهيدروجين H2 .
تشكل راسب أخضر المتمثل في شوارد الحديد الثنائي
سنهتم ألان بمعرفة ما نتج داخل الأنبوب و ذلك بإضافة بضع قطرات من الصودا
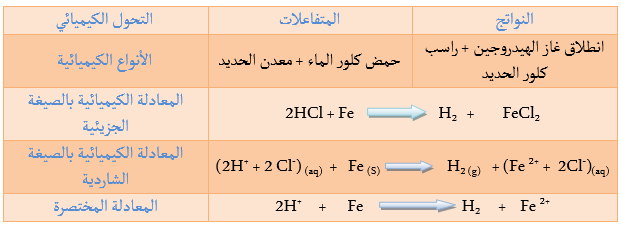
في البداية كان عندنا داخل الانبوب الحديد و حمض الكلور
في النهاية اختفى الحديد
نكتب اذن معادلة التفاعل
كلور الحديد الثنائي + غاز الهيدروجين
نلاحظ أن شوارد الكلور بقيت كما هي أي أنها لم تتفاعل اذن يمكن اختصار المعادلة في الشكل الموالي
عند سكب حمض كلور الماء على برادة الحديد تتحول شوارد الهيدروجين
H2 وفق ما يلي :
إن الإلكترونات التي تكتسبها شوارد الهيدروجين هي إلكترونات فقدها الحديد
بينما جزيء الهيدروجين
كل حبيبات المادة المجهرية ( الذرة، الجزيء، الشاردة، البروتون والإلكترون) تدعى أفرادا كيميائية.
نفسر التحولات الكيميائية على المستوى ألمجهري (غير المرئي) باستخدام الأفراد الكيميائية.
مجموعة من الأفراد الكيميائية المتماثلة كمجموعة من الذرات و الجزيئات تسمى نوعا كيميائيا.
نتعامل على المستوى العياني بالأنواع الكيميائية.
جزيء الأكسجين فرد كيميائي بينما غاز الأكسجين المتكون من عدد من الجزيئات يعتبر نوعا كيميائيا.
جزيء الحديد
الأدوات المستخدمة: أنبوب اختبار- محلول كبريتات النحاس- نشارة الحديد – محلول الصودا
الخطوات:
نضع في أنبوب اختبار محلول كبريتات النحاس
نغمس في المحلول نشارة الحديد.
بعد ثواني نلاحظ ترسب مادة حمراء على نشارة الحديد المغمور في كبريتات النحاس.
بعد مدة كافية نلاحظ اختفاء اللون الأزرق تدريجيا.
المادة الحمراء التي ترسبت فوق النشارة عبارة عن ذرات النحاس
نرشح محتوى الانبوب ثم نضيف قطرات من هيدروكسيد الصوديوم للمحلول فنلاحظ
تشكل راسب أخضر فاتح دلالة على وجود شوارد الحديد الثنائي
تتحول شاردة النحاس الثنائي إلى ذرة نحاس بعد اكتساب إلكترونين من ذرة الحديد التي تتحول بدورها إلى شاردة الحديد الثنائي
إن اختفاء اللون الأزرق (لون شوارد النحاس) وظهور اللون الأخضر (لون شوارد الحديد الثنائي) دليل على اختفاء شوارد النحاس في الوقت الذي تظهر فيه شوارد الحديد الثنائي.
نعبر عن هذا التحول بالمعادلتين التاليتين:
من خلال العبارات السابقة يمكن إعطاء تعريف للتفاعل الكيمائي على أنه :
تغيراً يطرأ على المواد ، ويشتمل على تكسير روابط وتكوين روابط جديدة ، تؤدي إلى إعادة ترتيب الذرات ، فينتج بذلك مواد جديدة تختلف في صفاتها عن المواد المتفاعلة .
هناك إشارات تدل على حدوث تفاعل كيميائي ، ومن هذه الإشارات :
- انطلاق الغاز .
- تغير اللون .
- تغير درجة حرارة محتويات إناء التفاعل .
- تكون راسب .
نحقق التركيب التجريبي أعلاه بحيث نقوم بوزن كتلة الطباشير والخل قبل التفاعل ثم نزنها بعد التفاعل
نلاحظ أن الكتلة لا تتغير
خلال تفاعل كيميائي يحدث في وسط مغلق( وسط يكون فيه التبادل مع الوسط الخارجي مستحيل) تكون كتلة المتفاعلات تساوي الى كتلة النواتج.
قانون لافوازي: "لا شيء يستحدث ولا شيء يضيع كل ما يحدث هو تحول أو إعادة ترتيب"
تعتبر المعادلة الكيميائية طريقة مثالية لوصف التفاعل الكيميائي برموز ، ووصف الظروف التي تم فيها التفاعل ، ووصف الحالة الفيزيائية للمتفاعلات والنواتج .
لكتابة المعادلة الكيميائية بصورة صحيحة يتطلب التالي :
- معرفة المواد المتفاعلة والمواد الناتجة .
- معرفة الرموز الصحيحة للعناصر والصيغ الكيميائية للمركبات المتفاعلة والناتجة .
- معرفة رموز الحالة الفيزيائية .
إذا لم تكن تعرفها فهي موضحة في الجدول التالي
- مراعاة قانون حفظ المادة عند موازنة المعادلة
اكتب معادلة موزونة تمثل تفاعل الألومنيوم مع غاز الأكسجين لإنتاج أكسيد الألومنيوم الصلب .
أولاً : نحدد المواد المتفاعلة والمواد الناتجة
ثانياً : نكتب صيغ العناصر والمركبات الداخلة في التفاعل .
أكسجين :
ألومنيوم :
ثالثاً :
رابعاً : نحقق قانون حفظ المادة بموازنة المعادلة.
انظر إلى عدد الذرات قبل الموازنة .
لموازنة ذرات الألومنيوم ، اضرب ذرات الألومنيوم للمواد المتفاعلة في (2) تذكّر دائماً أنه أثناء موازنة المعادلة الكيميائية لا يجوز تغير الصيغ الكيميائية للمواد ، ولذلك توضع المعاملات على يسار الصيغة .
لاحظ أن ذرات الألومنيوم أصبحت موزونة .
ولكن ذرات الألومنيوم اختل عددها عند موازنة الأكسجين ، وعليه نعود لموازنة الألومنيوم بضرب
التحقق من الموازنة :
تسمى عملية الموازنة بهذه الطريقة باسم طريقة المحاولة والخطأ . عرفت الآن السبب لهذه التسمية !!
بما أن شاردة الكبريتات لم تشارك في التفاعل فإنه يمكن الاستغناء عنها ونكتب المعادلة مختصرة كما يلي:
نكتب المعادلة الكيميائية للتفاعل السابق.
خلال التفاعل الكيميائي تبقى الكتلة محفوظة لذلك يجب موازنة الطرفين.
خلال التفاعل الكيميائي تبقى الشحنة محفوظة أي مجموع الشحنات الكهربائية قبل التفاعل يساوي مجموع الشحنات الكهربائية بعد التفاعل.
يمكن كتابة معادلة كيميائية مختصرة بحذف الأفراد التي لم تشارك في التفاعل (هنا نحذف
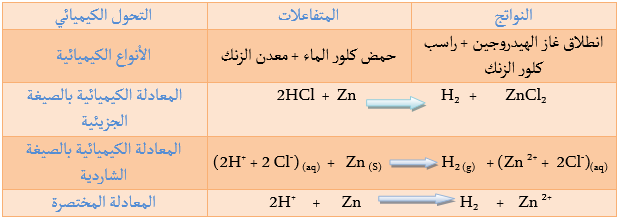
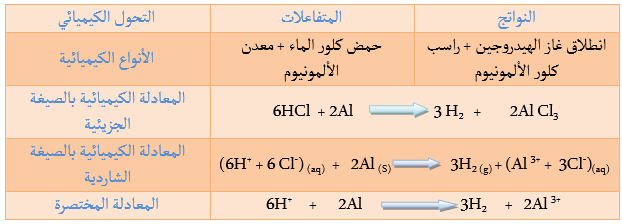
يتفاعل حمض كلور الماء مع بعض المعادن Fe, Zn, Al فيتشكل كلور المعدن وينطلق غاز الهيدروجين.
غاز الهيدروجين + كلور المعدن
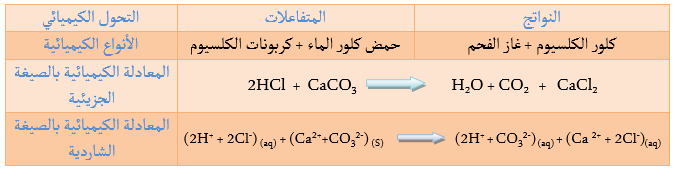
نسكب قطرات من حمض كلور الماء
نلاحظ انطلاق غاز يعكر رائق الكلس.
الغاز المنطلق هو ثنائي أكسيد الكربون.
كلور الكالسيوم+ ماء + ثنائي أكسيد الكربون
تكتب الشوارد بالطريقتين الآتيتين:
تكتب شاردة الهيدروجين في المحلول الشاردي بإحدى الطريقتين:
لا يتفاعل حمض كلور الماء مع معدن النحاس

نتحصل على نفس النتيجة عند استبدال صفيحة الحديد بصفيحة من الزنك
- إختبارات
- 39
- الأجوبة الصحيحة
- False
- الأجوبة الخاطئة
- False
- مجموع النقاط
- False
المراتب الخمس الأولى في Quiz
- maram hm
- 289 نقطة
-

- Înës Djãøûî
- 240 نقطة
-

- Nosa nono
- 239 نقطة
-

- سارة غامنية
- 220 نقطة
-

- Ameziane Ameur
- 215 نقطة
-

- AYOUB BOUGUEZZA
- 200 نقطة
-

- Nard_jesse Nardjesse
- 200 نقطة
-
- NoSşà MiSş
- 200 نقطة
-
- Hanouna Janine
- 200 نقطة
-
- Santfreche Lilya
- 200 نقطة
-









