هندسة أفراد بعض الأنواع الكيميائية
أكمل الجدول الآتي :
|
الذرات |
|
|
|
|
|
|
الجزيئات |
|
|
|
|
|
|
التوزيع الإلكتروني على المدارات |
|
|
|
|
|
|
عدد الإلكترونات في المدار الأخير |
|
|
|
|
|
|
عدد إلكترونات تشبع المدار الأخير |
|
|
|
|
|
|
قيمة x,y,z في الصيغ الجزيئية |
|
|
|
|
|
|
التوزيع الإلكتروني لذرات الجزيئ |
|
|
|
|
|
تمثيل لويس للذرات يخضع للقواعد التالية:
- يكتب رمز العنصر الكيميائي
- يحاط برمز العنصر نقاط تمثل إلكترونات الطبقة السطحية
- يرمز للإلكترونات المتزاوجة بنقطتين متجاورتين أو قطعة مستقيمة صغيرة
- يرمز للإلكترون الحر بنقطة
هو عدد الإلكترونات الفردية في الطبقة السطحية .في المثال السابق وحسب تمثيل لويس: تكافؤ
هو فرد كيميائي متعادل كهربائيا يتكون من ارتباط عدد من الذرات وهو نوعان :
- الجزيء البسيط: يتكون من ذرتين أو أكثر من نفس النوع الكيميائي مثل:
- الجزيء المركب: يتكون من ذرات لعناصر كيميائية مختلفة مثل:
هي مشاركة إلكترونية بين ذرتين أو أكثر ينتج عنها ترابط الذرات فتكون بذلك الجزيئات :
فإذا كانت مشاركة ذرتين بإلكترون واحد لكل منهما سميت رابطة تكافئية أحادية ( البسيطة) وإذا كانت مشاركة ذرتين بإلكترونين منفردين لكل منهما سميت رابطة تكافئية ثنائية وإذا كانت مشاركة ذرتين بثلاثة إلكترونات منفردة لكل منهما سميت رابطة تكافئية ثلاثية
- نموذج لويس للرابطة التكافئية :
ترتبط الذرتان A.B برابطة تكافئية أي تشتركان في زوج الكتروني بحيث كل ذرة تساهم بإلكترون سطحي الزوج الإلكتروني غير الرابط:
- عدد الروابط التكافئية الممكنة لذرة عنصر:
ليكن p عدد الإلكترونات في المدار الخارجي لذرة.
من أجل تحقيق قاعدة الثمانية ترتبط الذرة مع ذرات أخرى بواسطة
|
عدد الروابط التكافئية |
عدد الإلكترونات في المدار الخارجي p |
ذرة العنصر |
|
2-1=1 |
1 |
H |
|
8-7=1 |
7 |
Cl |
|
8-6=2 |
6 |
O |
|
8-5=3 |
5 |
N |
|
8-4=4 |
4 |
C |
تمثل الرابطة التكافئية بخط صغير يفصل بين رمزي العنصرين المترابطين
الجزيء
- التوزيع الالكتروني للذرة
- التوزيع الالكتروني للذرة
- العدد الإجمالي للإلكترونات في الطبقات السطحية
- عدد الثنائيات التي يمكن تحقيقها
- الاحتمال الوحيد لتحقيق عدد الثنائيات مع احترام قاعدتي الثنائية والثمانية
يطلب من التلاميذ تكملة الجدول التالي الذي يعبر عن تمثيل لويس لجزيء HCl (كلور الهيدروجين) منهجية إيجاد تمثيل لويس لجزيء .
عند حدوث ترابط بين الذرات لتكوين جزيئات وعندما يكون بين الذرات فرق في الكهروسلبية كبير ( أحد الذرات واقعة في الأعمدة الأولى من الجدول الدوري والأخرى واقعة في الأعمدة الأخيرة من الجدول الدوري) فإن كثافة السحابة الإلكترونية حول الذرات الكهروسلبية تكون أكثف ، مما يجعل الجزيء يتكون من قطبين أحداهما موجب والآخر سالب ومن أمثلة الجزيئات المستقطبة : الماء
هي رابطة تنشأ بين الجزيئات المستقطبة بفعل التجاذب بين الذرات التي تحمل قطب موجب والذرات التي تحمل قطب سالب في جزيئات أخرى ، إن وجود هذه الروابط تضفي على المركبات خواص فيزيائية كالانحلال وارتفاع درجة الغليان .
جزيئات الماء تجمعها روابط هيدروجينية .
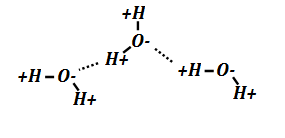
يعتبر نموذج لويس قاصرا على تفسير بعض خصائص الجزيئات لأنه يصفها بشكل مستوى في حين للذرات والجزيئات توزع في الفراغ وقد اقترح العالم Roland Jillespie سنة 1957 نموذج لتوزع الروابط التكافئية يعتمد على التنافر بين الأزواج الإلكترونية يبرز من خلاله الزوايا بين الروابط وأبعادها ويمثل كل جزيء بصيغة تعرف بالصيغة الرمزية.
وهي من الشكل
- : الذرة الرئيسية في الجزيء ،: الذرات الثانوية في الجزيء ،
- : عدد إلكترونات التكافؤ في الذرة( عدد الأزواج الالكترونية الرابطة للذرة المركزية ) .
- : يرمز الى وجودزوج الكتروني غير المرتبطة في الذرة.
- إذا كان فإن الجزيء له شكل هرم رباعي الوجوه تتوسطهورؤوسه الذرات
- إذا كان فإن الجزيء له شكل هرم رباعي الوجوه في رأسهورؤوسه الأخرى الذرات
- إذا كان فأن الجزيء له شكل خطي .
تمثل الجزيئات بنموذج جلسبي باتباع القواعد التالية :
- هندسة الجزيء أو الشاردة يعتمد على عدد الأزواج الالكترونية الرابطة ( n ) وغير الرابطة ( m ).
- يعد الزوج الالكتروني المنفرد كأنه زوج الكتروني رابط .
- الرابطة التكافئية الثنائية أو الثلاثية تعد كأنها زوج الكتروني .
- تترتب الأزواج الالكترونية في طبقة التكافؤ لذرة ما ، بطريقة تجعلها تتباعد فيما بينها الى أكبر مدى ممكن .
أكمل الجدول الآتي :
يمثل الترميز ( الصيغة الرمزية) جزيء ذرته المركزية
- أعط مثال عن كل صيغة رمزية .
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
1 |
|
|
|
|
2 |
|
|
0 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
مثال |
|
|
|
|
|
|
|
الشكل الفضائي |
|
|
|
|
|
|
- كيف تتوزع الذرات حول الذرةفي كل صيغة ؟ وصف شكل كل جزيئ وفق تمثيل جيلسبي .
للتعبير عن البنية الفضائية للجزيئات وإبراز الشكل الهندسي لها إقترح العالم Donald Cram تمثيلا رمزيا للجزيئات يحدد موضع الروابط في الفضاء كالتالي :
- تمثل الروابط الواقعة في مستوى الرسم بخطوط عادية .
- تمثل الراوبط الواقعة خلف مستوى الرسم بخط مهشر ( متقطع) .
- تمثل الروابط الواقعة أمام الرسم بخط مملوء .
مثل الجزيئات الآتية باستعمال نموذج كرام
- التماكب هو التشابه في الصيغة المجملة والاختلاف في البنية الفراغية أو المستوية .
- والمتماكبات هي أفراد كيميائية لها نفس الصيغة المجملة وتختلف في الصيغة المفصلة .
الجزيء
- أكمل الجدول الآتي :
|
الجزيئ |
تمثيل لويس |
الصيغة الرمزية |
الشكل الفضائي |
تمثيل كرام |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- أوجد متماكبات( الصيغ المفصلة) للجزيئات الآتية : ,.









