نموذج الغاز المثالي
نلاحظ أن الماء لا يتسرب إلى داخل القارورة أي أنه هناك قوة تمنع الماء من التسرب إلى داخل القارورة ناتجة عن الهواء الموجود بها.
نحضر حقنة فارغة و نسحب مكبسها إلى سعتها العظمى ثم نسد فوهتها لنحاول الضغط على المكبس فنلاحظ أنه لا يمكننا أن نصل بالمكبس إلى قاع الحقنة، و عند ترك المكبس حرا يعود إلى وضعه الأول.
يفسر ذلك كون الهواء يؤثر بقوة ضاغطة معاكسة للأثر الخارجي.
ندخل بالونا مطاطيا مملوءا بالهواء داخل حوض مائي ثم نثقبه في موضع فنلاحظ خروج الهواء بمنحى عمودي على سطح البالون
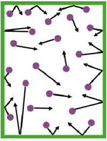
جزيئات حرة في حركة عشوائية دائمة بسرعات كبيرة ينتج عنها تصادمات فيما بينها ومع جدران الإناء المتواجدة فيه.
أول من صاغ تعريفا للضغط هو برنولي Daniel Bernoulli سنة 1738 ينتج عن التصادمات بين جزيئات الغاز و السطح الداخلي للإناء الموجودة فيه قوة تدعى القوة الضاغطة تتوزع على السطح الداخلي.
الضغط هو مقدار فيزيائي يمثل النسبة بين القوة الضاغطة إلى مساحة السطح المضغوط
حيث :
يعتبر غاليلي أول من تحدث عنه ليليه تلميذه طوريشيلي TORRICELLI سنة 1643 الذي قام بقياس قيمته بتجربته الشهيرة
- مقياس الضغط التفاضلي manomètre différentiel : يقارن ضغط الغاز بالضغط الجوي في تلك اللحظة.
- مقياس الضغط المطلق manomètre absolu : و يقيس قيمة الضغط الحقيقية.
- الوحدات:
الباسكال
الجو
البار
عمود الزئبق

نضع في بالونتين زجاجيتين ماء ملون و مزودين بأنبوبين رقيقين بحيث مستوى الماء متماثل في كليهما.نضع البالون الأول في الماء الساخن نضع البالون الثاني في الماء البارد
- ماذا تلاحظ ؟ كيف تعلل ذلك؟
- نضع الآن البالونين في الماء . ماذا تلاحظ ؟ كيف تعلل ذلك؟ماذا تستنتج من هذه التجارب؟
في الأجسام الساخنة تتحرك جزيئات المادة بسرعة كبيرة و منه حركتها العشوائية تزداد كلما كانت درجة حرارتها أكبر.
تقاس درجة الحرارة بالمحرار / الترمومتر (thermomètre )
وحدته الدرجة مئوية و رمزها (°c) و يقشسم لإلى مائة 100 تدريجة الصفر تنطبق على درجة تجمد الماء و 100 على درجة تبخره .
الصورة للعالم الإيرلندي بويل 1627-1691 ماريوت عالم فرنسي 1620-1684
ينص القانون على ما يلي"عند درجة حرارة ثابتة ، الضغط
في حجم ثابت يتناسب ضغط غاز طردا مع درجة الحرارة مقدرة بالدرجة المئوية(°c) أي يزداد الضغط الناتج عن غاز متوازن بزيادة درجة الحرارة الغاز
أعتمدها كالفن كمبدأ لسلم سمي على اسمه مقسم إلى درجات مطلقة
يمكن كتابة قانون شارل بدرجة الحرارة المطلقة
تحت ضغط ثابت يتناسب حجم غاز
يزداد ضغط غاز في حجم ثابت و درجة حرارة ثابتة كلما زاد عدد مولاته
من الدراسات السابقة وجدنا أن:
ومنه يمكن كتابة العلاقة
حيث الجداء
هو نموذج للغازات الحقيقية حيث يمكن اعتبارها كمثالية اي ان القانون السابق ينطبق عليها في درجة حرارة منخفضة و ضغط منخفض تحت الشروط السابقة يمكن اعتبار الغازات الحقيقية متماثلة و لها نفس التصرف الفيزيائي و نمثلها بنفس النموذج المثالي .
الغاز المثالي هو غاز مكون من حبيبات متماثلة مهملة الأبعاد تتحرك في حركة عشوائية دائمة تخضع في حالتها الماكروسكوبية لقانون الغاز المثالي









