تعيين كمية المادة عن طريق قياس الناقلية
نأخذ أنابيب اختبار ونرقمها من (1) إلى(10) كما في الجدول ثم نملأها بالماء المقطر.
|
رقم الأنبوب |
المادة المضافة |
رقم الأنبوب |
المادة المضافة |
|
1 |
برمنغنات البوتاسيوم |
6 |
كحول الإيثلي |
|
2 |
كلور الصوديوم |
7 |
شراب الشاي |
|
3 |
كبريتات النحاس |
8 |
كبريتات الباريوم |
|
4 |
سكر |
9 |
زيت |
|
5 |
سكر+ كلور الصوديوم |
10 |
رمل |
نضيف لكل أنبوب المادة المقترحة في الجدول مع رجها قــليلا .
- أكمل الجدول التالي بوضع علامة(×) في الخانة المناسبة :
|
رقم الأنبوب |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
خليط متجانس |
|
|
||||||||
|
خليط غير متجانس |
|
|
|
|
|
|
|
|
نلاحظ في كل أنبوب تشكل خليط من طور واحد (متجانس) أو طورين متمايزين (غير متجانس ).
|
رقم الأنبوب |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
خليط متجانس |
× |
× |
× |
× |
× |
× |
× |
× |
|
|
|
خليط غير متجانس |
|
|
|
|
|
|
|
|
× |
× |
الخليط مزيج من مادتين أوأكثر ’ نعتبره غيرمتجانس .إذا أمكن تمييزمكوناته بالعين المجردة ’وإذا تعذر ذلك نقول أنها متجانسا ونسميه حينئذ محلولا.
نأخذ 04 أنابيب اختبار ونرقمها من (1) إلى (04) ثم نملأ الأنابيب بالماء المقطر إلى الثلثين .ونضع في كل أنبوب المواد التالية :
|
رقم الأنبوب |
1 |
2 |
3 |
4 |
|
المادة |
|
|
|
سكر |
|
الملاحظة |
محلول متجانس |
محلول متجانس |
محلول متجانس |
محلول متجانس |
- كيف تفسر توزع اللون في الأنبوب (1) والأنبوب(3)؟
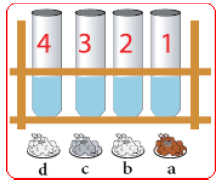
- الأنبوب (1) : نلاحظ محلول بنفسجي ناتج عن إنحلال بلورات برمنغنات البوتاسيوم البنفسجية في الماء المقطر الشفاف
- الأنبوب(3) : نلاحظ محلول أزرق ناتج عن تشرد ملح كبريتات النحاس في الماء المقطر وحركة الشوارد الزرقاء في المحلول.
المخلول المائي خليط متجانس يتكون من مادتين أو أكثر لايمكن أن نميز بينها بالعين المجردة ’وتكون لجميع أجزائه نفس الخواص.
نأخذ ثلاثة أنابيب اختبار ونضع في كل أنبوب
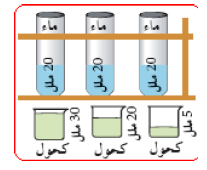
- أكمل الجدول التالي :
|
رقم الأنبوب |
1 |
2 |
3 |
|
حجم الماء |
20 |
20 |
20 |
|
حجم الكحول |
5 |
20 |
30 |
|
اسم المذيب |
|||
|
اسم المذاب |
|||
|
اسم المحلول |
|
رقم الأنبوب |
1 |
2 |
3 |
|
حجم الماء |
20 |
20 |
20 |
|
حجم الكحول |
5 |
20 |
30 |
|
اسم المذيب |
ماء |
ماء أو كحول |
كحول |
|
اسم المذاب |
كحول |
كحول أو ماء |
ماء |
|
اسم المحلول |
محلول مائي |
محلول مائي أو محلول كحولي |
محلول كحولي |
نسمي المحل أو مذيب المادة التي تكون كميتها في المحلول أكبر ’ونسمي المذاب أوحلالة المادة التي كميتها أٌقل.وعندما يكون المذيب هوالماء نسمي المنتوج محلولا مائيا.
نركب دارة كهربائية مكونة من مصباح ومولد ولبوسين (سلكين غير ناقلين ).
- نضع كمية من بلورات في بيشر ثم ندخل فيها اللبوسين كما في الشكل .
الملاحظة: نلاحظ بلورات
- نضيف كمية من الماء إلى البيشر الذي يحتوي .
الملاحظة: نلاحظ تحرر الشوارد
- نعيد نفس التجربة بإستعمال (السكر) ; ;
الملاحظة :
(السكر) :نلاحظ انه لايمرر التيار الكهربائي لأن جزيئاته تبقى متعادلة كهربائيا ولاتوجد حاملات الشحنة
- ماهي المحاليل التي تمرر التيار الكهربائي ؟
- بماذا تمتاز المحاليل المائية التي تمرر التيارالكهربائي ؟ وكيف نسميها؟
- بماذا تمتاز المحاليل المائية التي تمرر التيار الكهربائي ؟ وكيف نسميها ؟
- هي المحاليل الشاردية فقط – الكهرليتات.
- تمتاز بخاصية الناقلية للكهرباء كونها محاليل شاردية وتسمى بالمحاليل الشاردية أو الكهرليتات
- تمتاز بخاصية عدم الناقلية كونها محاليل غير شاردية وتسمى نتيجةلذلك بالمحاليل الجزيئية .
في الجسم الصلب الشاردي ’ الشوارد تحتل مواقع معينة ولا تنقل فالجسم الصلب الشاردي معتدل كهربئيا وعند ‘نحلاله في الماء تنفصل الشوارد مكونة شحنات (شوارد) حرة الحركة في المحلول فيكون حينئد ناقلا للتيار الكهربائي . بينما السكر يحتوي على روابط تكافؤية وعند إنحلاله في الماء تنفصل جزيئاته ولكنها تبقىمتعادلة فلا وجود لشحنات حرة في المحلول المائي الذي لا ينقل التيار الكهربائي .
- نأخذ مسطرة بلاستيكية ونقوم بدلكها بقطعة من الصوف . ثم قرب المسطرة من حنفية يسيل منها خيط رفيع من الماء.
- الملاحظة : نلاحظ إنجذاب الماء نحو المسطرة المدلوكة كما في الشكل .
- التفسير : لأن جزيئات الماء مستقطبة كهربائيا أي كل جزيء له قطبان كهربائيان وكل منهما يحمل شحنةجزئية أحدهما موجبة والاخر سالبة ، أي أن جزيء الماء مستقطب .
يحتوي جزئ الماء رابطة مستقطبة بين الأكسجين والهيدروجين ناتجة عن وضع إلكترون ذرة الهيدروجين وإلكترون من ذرة الأكسجين ليتكون زوج إلكتروني ، وهما إحصائيا قريبين من ذرة الأكسجين بدلا من ذرة الهدروجين . عدم التساوي في التوزيع يجعل ظهور شحنة عنصرية موجبة على كل من ذرتي الهيدروجين و شحنة سالبة على ذرة الأكسجين فيصبح جزيء الماء مستقطب أو قطبي.
نضع كمية من غاز كلور الهيدروجين في حوجلة مجففة ،بها سدادة يخترق مركزها أنبوب زجاجي .ثم ننكس الحوجلة فوق حوض من الماء.
الملاحظة : نلاحظ تدفق الماء من الحوض داخل الحوجلة بشكل نافورة مائية .
- هل غاز كلور الهيدروجين ينحل في الماء ؟ علل ؟
- إستعن بالجدول الدوري وحدد كهروسلبية كل فرد ؟
- قارن بين جزيء الماء وجزيء كلور الهيدروجين من حيث البنية ؟
- ماذا تستنتج ؟علل؟
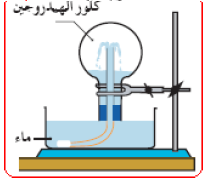
- نعم ينحل في الماء بشراهة لأن جزيئاته مستقطبة مثل الماء ويتشكل محلول مائي شاردي يتدفق الى الفراغ الذي خلفه الغاز المنحل داخل الحوجلة بتأثير الضغط الجوي الحارجي .
- يتشكل جزيء كلور الهدروجين من ذرة الهدروجين (عنصر كهروجابي) وذرة الكلور ( عنصر كهروسلبي) مرتبطتين برابطة تكافئية بسيطة مستقطبة.
- كلاهما جزيء مستقطب
- توجد روابط جزيئية بين جزيئات الماء بسبب قطبيتها وكذلك الحال بالنسبة لجزيئات كلور الهدروجين ، وعند إمتزاجهما ينحل الغاز في الماء مشكلا محلولا مائيا شارديا ناقل للكهرباء .
لغاز كلور الهيدروجين جزيءمستقطب .لذلك ينحل بشراهة في الماء. فعند ضغط 1بار ينحل
نملأ الوعاء إلى ثلثي حجمه بمحلول مائي لــ
- أرسم الدارة .
- هل المحلول يمرر التيار الكهربائي ؟.
- هل محلول كلور الهيدروجين شاردي ؟
- أكتب معادلة التفاعل أثناء الإنحلال ؟
- نعم
- نعم
يمر التيار في المحلول المائي لكلور الهيدروجين فنستنتج أن انحلال الغاز في الماء يصاحبه تشكل شاردة كلور
نذوب كمية من كل من:
الملاحظة :نلاحظ تشكل محاليل مائية بعضها ملون وبعضها لآخر شفاف ( غيرملون)
- ماهو لون كل أنبوب ؟ لأي سبب يرجع اللونين الناتجين ؟ علل إجابتك ؟
- الأنبوب (1) :أًصفر برتقالي
- الأنبوب (2):أزرق
- الأنبوب (3) :عديم اللون.
- يحتوي محلول (كبريتات النحاس) على شاردتي. ولونه أزرق
- يحتوي محلول ( كبريتات البوتاسيوم على شاردتي (K +)و.(SO42-) ولا لون له
- يحتوي محلول (بيكرومات البوتاسيوم ) على شاردتي.ولونه.أصفر برتقالي
- إذن يعود اللون ألأزرق لمحلول كبريتات النحاس لإحتوائه شوارد فقط .بينما يعود اللون أصفر برتقالي لمحلول بيكرومات البوتاسيوم لإحتوائه شوارد.فقط لأن شاردتيو. لاتلون المحلول المائي الذي يحتويها وذلك ما لاحظناه عن تذويب بلورات من(كبريتات البوتاسيوم) في الماء .
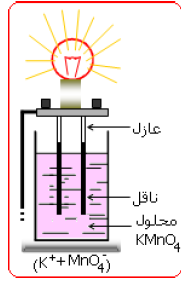
نأخذ ورقة ترشيح ونبللها بمحلول
- صف ماذا تشاهدعلى الورقة ؟
- صف ماذا يحدث بعد مدة (10دقائق أوأكثر) ؟
- حدد اللون الظاهر على ورقة الترشيح من جانب المصعد ومن جانب المهبط .مع التفسير.
- ماطبيعة التيار الكهربائي في المحاليل الشاردية ؟ إشرح آلية حدوثه
- قارن آلية النقل الكهربائي في المعادن مع آلية النقل في المحاليل الشاردية ؟
- نلاحظ إنحراف مؤشر الآمبير متر وإمتزاج لوني المحلولين في المنطقة الكائنة بين اللبوسين
- ينفصل اللونين الأزرق والبرتقالي عن بعضهما .
- المصعد: اللون البرتقالي بسبب هجرة الشوارد المصعدية سالبة الشحنة إليه أثناء سريان التيار في الدارة . المهبط: اللون الأزرق بسبب هجرة الشوارد المهبطية موجبة الشحنةإليه.
- التيار الكهربائي عموما عبارة عن حركة جماعية منظمة لحاملات الشحنة ويتم سريان التيار في المحاليل الشاردية الناقلة بالإنتقال المزدوج لشوارد المحلول بين المسريين المغمورين في المحلول حيث تتجه الشوارد السالبة نحو المسرى الموجب للتيار بينما الشواردالموجبة نحو المسرى السالب للتيار .
- ينتقل التيار الكهربائي في النواقل المعدنية بفضل انتقال الإلكترونات الحرة لذرات معدن السلك وبالإتجاه المعاكس لجهة انتقال الإلكترونات وفق الجهة الإصطلاحية دون انتقال المادة بينما في المحاليل الشاردية ينتقل بفضل الإنتقال المزدوج للشوارد الموجبة والسالبة أي أن المحاليل الشاردية تمتاز بناقليتها للكهرباء.
تعرف المقاومة
تقدر المقاومة الكهربائية
تعرف الناقلية بأنها مقلوب المقاومة بحيث :
نعتبر محلولا شارديا يتكون من شوارد أحادية الشحنة
نسمي
- لنفترض المحلول الشاردي ممدا، أي تركيزه المولي تكون الناقلية للمحلولحيثهي الناقلية النوعية للكتونوالناقلية النوعية للأنيون
- بما أما ان الشوارد تختلف في حجمها وطبيعتها فإن حركتها في المحلول تتعلق بهما وكذلك بدرجة الحرارة لذلك كل شاردة تتميز بناقليتها النوعية المولية أي أن،إذن
بصفة عامة في محلول ممدد
- معادلة انحلال المذاب في الماء :
إذن
نسمي
أي
المحلول الشاردي الممدد متعدد الشحنة مثلا:
فإن
* عند توظيف العلاقات السابقة يجب استعمال الوحدات في النظام العالمي
فمثلا:
مثال للناقلية النوعية المولية لبعض الشوارد عند
|
كاتيون |
|
أنيون |
|
|
|
35,0 |
|
19,9 |
|
|
05,0 |
|
7,63 |
|
|
7,35 |
|
7,81 |
|
|
7,34 |
|
7,14 |
|
|
6,89 |
|
6,13 |









