تعيين كمية المادة عن طريق المعايرة
ضع في كل أنبوب محلولا مائيا ( ليمون ، خل ، محلول الصابون ، محلول
- ما هو لون كاشف الهلينتين ؟
- ماذا تلاحظ بعد إضافة الكاشف إلى المحلول ؟
- املآ الجدول المقابل .
|
المواد |
اللون الطبيعي |
اللون مع الكاشف |
|
لليمون |
أصفر |
|
|
خل |
شفاف |
|
|
محلول الصابون |
شفاف |
|
|
بيكاربونات |
شفاف |
|
|
محلول ملح الطعام |
شفاف |
|
- رتب المحاليل حسب تماثل ألوانها بوجود الكاشف .
- يتميز الليمون بطعم شائع ؟ اذكره .
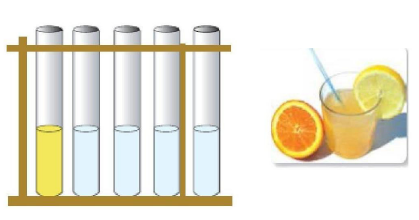
- لون كاشف الهلينتين هو برتقالي .
- بعد إضافة الكاشف إلى المحلول
- الجدول :
|
المواد |
اللون الطبيعي |
اللون مع الكاشف |
|
لليمون |
أصفر |
أحمر |
|
خل |
شفاف |
أحمر |
|
محلول الصابون |
شفاف |
برتقالي |
|
بيكاربونات |
شفاف |
أصفر |
|
محلول ملح الطعام |
شفاف |
برتقالي |
- ترتيب المحاليل حسب تماثل ألوانها بوجود الكاشف : أحمر ( ليمون + خل) ، برتقالي ( صابون + محلول ملح الطعام ) ، أصفر ( بيكاربونات ).
- الليمون طعمه الشائع هو حامض .
نسمي المحلول حمضيا كل محلول يأخذ فيه الهليانتين اللون الأحمر الذي يأخذه مع لون عصير الليمون . ونسمي محلولا أساسيا كل محلول يأخذ فيه الهليانتين اللون الأصفر الذي يأخذه مع البيكاربونات .
ضع محاليل مخففة من :
- ماذا تلاحظ بعد إضافة الكاشف إلى المحاليل ؟
- رتب المحاليل حسب تماثل ألوانها بوجود الكاشف .
- ما لون كاشف مع عصير الليمون .
- املآ الجدول
|
المحاليل الكيميائية |
لون الكاشف فيها |
|
|
|
|
|
|
|
|
|
|
عصير الليمون |
|
|
|
- صنف المحاليل السابقة إلى حمضية و أخرى أساسية
- بعد إضافة الكاشف إلى المحاليل تغير اللون إلى لون معين .
- ترتيب المحاليل حسب تماثل ألوانها بوجود الكاشف .
لون أصفر (
لون أزرق (
- لون كاشف مع عصير الليمون أصفر .
|
المحاليل الكيميائية |
لون الكاشف فيها |
|
|
أصفر |
|
|
أصفر |
|
|
أزرق |
|
عصير الليمون |
أصفر |
|
|
أزرق |
- تصنيف المحاليل السابقة إلى حمضية و أخرى أساسية :
الأحماض : (
الأسس : (
- النوع الكيميائي محلوله المائي حمضي يغير لون الكاشفالملون إلى الأصفر .
- النوع الكيميائي محلوله المائي حمضي يغير لون الكاشفالملون إلى ألأصفر .
- النوع الكيميائي محلوله المائي أساسي يغير لون الكاشفالملون إلى الأزرق .
- النوع الكيميائي محلوله المائي أساسي يغير لون الكاشفالملون إلى الأزرق .
غاز كلور الهيدروجين
- ما هي هذه الشوارد ؟
- كيف نسمي الفرد المتحصل عليه ؟
- ماذا يحدث لهذه الشاردة في وسط مائي ؟
- أكتب معادلة التفاعل المنمذج للتحول الكيميائي الحادث بين و الماء .
- استنتج معادلة التفاعل المنذمج للتحول الكيميائي الحادث أثناء تفاعل في الماء .
- ملاحظة : حمض فقد بروتون هيدروجين أثناء تفاعله مع الماء ، بينمافقد بروتونين أثناء تفاعله مع الماء .
- يتشرد الجزيء إلى شوارد ;
- نسمي الفرد المتحصل عليه بروتون هيدروجين .
- ترتبط هذه الشاردة في وسط مائي مع جزيء الماء .
الحمض هو كل مركب كيميائي جزيء أو شاردة يفقد بروتون هيدروجين
الأساس هو كل مركب كيميائي جزيء أو شاردة يكتسب بروتون هيدروجين
- حضر كمية من في بيشر ن و لاحظ اللون الأخضر للمحلول . كيف يمكن شرح هذا اللون إعتمادا على لونو
- ضف حجم من محلول تركيزهبحذر إلى محلولثم أكتب ملاحظاتك و أكمل الرسم مستخدما الألوان المناسبة .
- ما هو الفرد الكيميائي من بين المسبب للتحول المشاهد في التجربة .
- أضف كمية من ملح الطعام إلى كل كأس فيه محلول.
- اكتب ملاحظاتك المشاهدة بعد الإضافة و أكمل الرسم مستخدما الألوان المناسبة .
- اكتب معادلة التفاعل الكيميائية المنمذج لهذا التحول الكيميائي .
- يمكن شرح ظهور هذا اللون اعتمادا على لون و. هو أن عدد الأفراد الكيميائيةومتساوية و بالتالي اللون الأخضر هو مزيج بين اللون الأصفر المميز لو اللون الأزرق المميز للشاردة
- يتلون المحلول باللون الأصفر (الشكل 1)
- الفرد الكيميائي من بين المسبب للتحول المشاهد في التجربة هو
- أضف كمية من ملح الطعام إلى كل كأس فيه محلوللا تغير من لون المحلول .
- (الشكل 2)
- معادلة التفاعل الكيميائي المنمذج اهذا التحول الكيميائي :
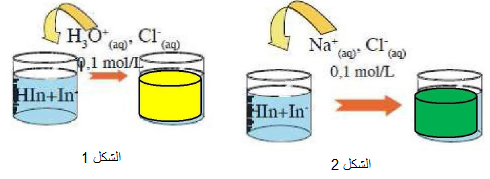
إن اختفاء اللون الأخضر و ظهور اللون الأصفر يدل على اختفاء شوارد
- عين الحمض في كل تحول كيميائي تنمذجه المعادلة الكيميائية التالية ، و ما هو عدد المفقود في كل حمض
ضع كمية من محلول
- اكتب ملاحظاتك بعد الإضافة و أكمل الرسم مستخدما الألوان المناسبة .
- أعد التجربة مع محلول كلور الصوديوم
- هل يحدث تغير في اللون .
- هل هذا التحول يمكن أن تسببه الشاردة ؟ علل
- ما هو الفرد الكيميائي المسؤول عن هذا التحول ؟
- اكتب معادلة التحول الكيميائية المنمذج لهذا التحول الكيميائي .
- يتلون المحلول باللون الأزرق
- (الشكل)
- لا يتغير اللون
- التحول لا يمكن أن تسببه الشاردة لأنها شاردة موجبة لا يمكنها أن تكتسب بروتون هيدروجينالذي تفقدهلتعطينا
- الفرد الكيميائي المسؤول عن هذا التحول هو
اللون الأخضر لمحلول أزرق البروموتيمول تحول إلى اللون الأزرق بعد إضافة محلول
مما سبق و حسب تعريف برونشتد لوري : الحمض
و الأساس
نعرف الثنائية (Acide/Base) بكونها الجملة المكونة من الحمض
و نكتب الثنائية (Acide/Base) ;
يتفاعل حمض الإيثانويك éthanoïque مع الماء وفق المعادلة التالية :
الثنائيات (Acide/Base) هما :
معايرة نوع كيميائي في محلول ما هي إلا تحديد تركيزه المولي في هذا المحلول .
مثل معايرة الكوليسترول في الدم . معايرة شاردة الهيدرونيوم
عند التكافؤ يكون المتفاعل المعاير و المتفاعل المعايَر قد استهلكا كليا .
ضع
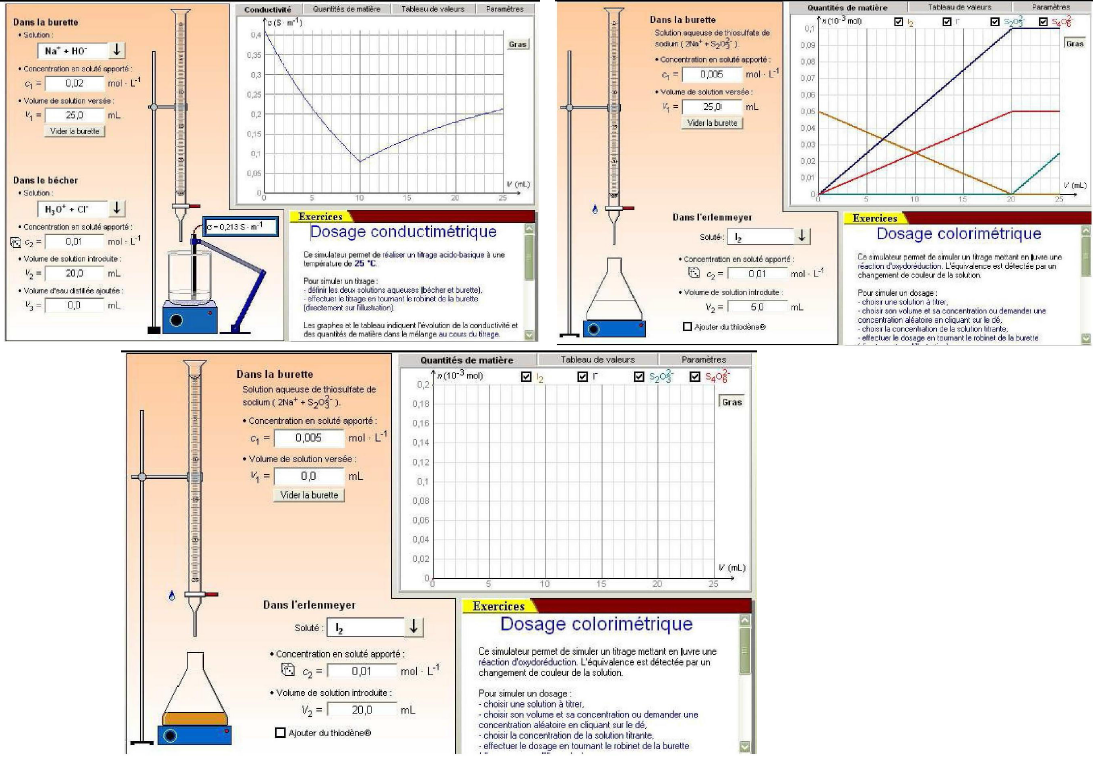
- املآ السحاحة بالمحلول المحضر من ثم اضبط سطح المحلول داخل السحاحة على إشارة الصفر .
- شعل المحرك المغناطيسي ، ثم ابدأ بإضافة قطرات من محلول بواسطة السحاحة .
- ما هي الأدوات اللازمة لأخذ من محلول
- ما هو لون المحلول في البيشر عند إضافة كاشف ؟ ( قبل إضافة المحلول الأساسي من السحاحة ) .
- عند إضافة الأساس على الحمض فإنه يحدث تفاعل حمض – أساس .ما هي الثنائيتين حمض – أساس الداخلتين في التفاعل ؟
- أكتب معادلة التفاعل الكيميائية الحادثة .
- الأدوات اللازمة هي ماصة سعته مجهزة بإجاصة .
- لون المحلول في البيشر عند إضافة كاشف هو أصفر .
- الثنائيتين حمض – أساس الداخليتين في التفاعل : ;
في بداية المعايرة تبدأ بإضافة قطرات من محلول
- هل يحدث تغير لوني للمحلول ؟ علل إجابتك .
- ما هو المتفاعل المحد للتفاعل حمض – أساس في بداية المعايرة .
- حدد المتفاعل الموجود بزيادة و املآ جدول تقدم التفاعل من اجل حجم مضاف من الأساس
- يحافظ المحلول على لونه الأصفر غير أنه مع استمرار العمل تخف شدة اللون وذلك لتفاعل
- المتفاعل المحد للتفاعل حمض – أساس في بداية المعايرة
- المتفاعل الموجود بالزيادة هو
أكمل إضافة قطرات من محلول
- ما هو اللون الجديد للمحلول في البيشر ؟ اشرح لماذا تحدث الظاهرة .
- احسب التقدم باستخدام جدول تقدم التفاعل السابق . بدلالة;ثم بدلالة;إذا علمت أنه في هذه الحالة المتفاعلات تفاعلت كليا .
- ارمز بالرمزو أوجد العلاقة بين :;;;حيث
- احسب التركيزلمحلول
- احسب النسبة بين كمية مادة المتفاعلين عند نقطة التكافؤ و قارنها مع النسبة بين الأعداد الستكيومترية .
- اللون الجديد للمحلول في البيشر هو الأخضر لأن عند نقطة التكافؤ يكون المتفاعل المعاير و المتفاعل المعايَر قد استهلكا كليا و عليه تتساوى كمية المادة لكل من و
- حساب التقدم باستخدام جدول تقدم التفاعل السابق ن بدلالة;ثم بدلالة;إذا علمت أنه في هذه الحالة المتفاعلات تفاعلت كليا :
- العلاقة بين ;;;حيث:
لدينا :
استمر في إضافة الأساس .
- هل يتغير اللون ؟علل إجابتك .
- ما هو المتفاعل المحد الآن ؟
- يتغير اللون إلى الأزرق و ذلك لاختفاء كل الشوارد ، نتيجة تفاعلها معويساعد استمرار إضافة شواردفي زيادة تواجدها في المحلول و منه يحدث للكاشف التالي :
- المتفاعل المحد الآن هو :
محلول
نضع في بيشر سعته
| 20 | 19 | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 7 | 5 | 3 | 1 | 0 | |
- اكتب معادلة التفاعل .
- احسب كمية المادة ل
- أرسم المنحنى
- عين نقطة التكافؤ على الرسم . ما هو الحجم عند التكافؤ ؟
- ما هو تركيز حمض كلور الماء ؟
| 27 | 25 | 24 | 23 | 22 | 20 | 16 | 12 | 8 | 4 | 0 | |
| 6,49 | 6,49 | 6,48 | 6,52 | 6,5 | 6,56 | 6,55 | 6,55 | 6,48 | 6,45 | 6,5 | |
| 51,3 | 45,1 | 44 | 42,1 | 40,6 | 41,4 | 49,3 | 59,7 | 71,7 | 82,7 | 92,5 | |
- معادلة التفاعل :
| 27 | 25 | 24 | 23 | 22 | 20 | 16 | 12 | 8 | 4 | 0 | |
| 6,49 | 6,49 | 6,48 | 6,52 | 6,5 | 6,56 | 6,55 | 6,55 | 6,48 | 6,45 | 6,5 | |
| 51,3 | 45,1 | 44 | 42,1 | 40,6 | 41,4 | 49,3 | 59,7 | 71,7 | 82,7 | 92,5 | |
| 7,90 | 6,95 | 6,79 | 6,46 | 6,25 | 6,31 | 7,53 | 9,11 | 11,06 | 13,82 | 14,23 | |
| لون الكاشف |
- أرسم المنحنى (الشكل)
- الحجم عند التكافؤ
- تركيز حمض كلور الماء
ضع كمية من محلول
انتظر
- سجل ملاحظاتك حول المحلول و قطعة النحاس .
- هل حدث تحول كيميائي ؟ برر إجابتك .
- ما هو اللون الجديد الظاهر في المحلول ؟
- ما هي الشاردة التي لونت المحلول ؟
- أكتب معادلة تفاعل كيميائية تنمذج التحول الكيميائي الذي حدث لذرة النحاس و حولها .
- هل ظهر جسم جديد ؟ ما لونه ؟ برر .
- أكتب معادلة تفاعل كيميائي تنمذج التحول الحاصل لشاردة الفضة و التي تحولت إلى
- المحلول يتلون بالأزرق و قطعة النحاس تتآكل .
- نعم حدث تحول كيميائي ، و ذلك لاختفاء متفاعلات و ظهور نواتج جديدة .
- اللون الجديد الظاهر في المحلول هو اللون الأزرق .
- ما هي الشاردة التي لونت المحلول
- نعم ظهر جسم جديد لونه أبيض يسود في وجه الضوء و ذلك لتحول شوارد الفضة إلى معدن الفضة .
عند إدخال قطعة النحاس في نترات الفضة
نضع في أنبوب اختبار حجما من محلول كبريتات النحاس
- ماذا تلاحظ ؟
- أكمل الرسم مستعملا الألوان المناسبة انتهاء التفاعل .
- هل يحدث تحول كيميائي ؟ برر إجابتك .
- ما هو اللون المختفي ؟اشرح سبب الظاهرة .
- ما هو الجسم الجديد الظاهر .
- أكتب معادلة تنمذج التحول الكيميائي الذي يحدث لشاردة النحاس إلى؟
- أكتب معادلة تنمذج التحول الكيميائي للزنك أوو تحولها إلى شاردةأو
- حدد المؤكسد و المرجع في التحولات الكيميائية .
- نلاحظ تغير لوني لمحلول
- (الشكل)
- نعم يحدث تحول كيميائي لاختفاء متفاعلات و ظهور نواتج جديدة .
- اللون المختفي الأزرق و ذلك لتحول شوارد إلى معدن النحاس
- الجسم الجديد الظاهر هو معدن النحاس .
- ;
- المؤكسد هو و المرجعأو
- المرجع : هو كل نوع كيميائي قادر أن يفقد إلكترون أو أكثر خلال تحول كيميائي .
- المؤكسد : هو كل نوع كيميائي قادر أن يكتسب إلكترون أو أكثر خلال تحول كيميائي
في التجارب السابقة لاحظنا أن شاردة النحاس
تعميم : يكون نوعان كيميائيان ثنائية مؤكسد / مرجع (Ox/Red) إذا كان بالإمكان التحول من نوع إلى أخر باكتساب أو فقدان إلكترون أو أكثر .
- مما سبق :
الأكسدة : هو تحول كيميائي يصاحبه فقدان الإلكترونات من ذرة أو مجموعة من الذرات .
الإرجاع : هو تحول كيميائي يصاحبه اكتساب الإلكترونات من ذرة أو مجموعة من الذرات .
حدد الثنائية مؤكسد / مرجع في التحولات المنمذجة بالمعادلات النصفية أكسدة – إرجاع محددا المؤكسد و المرجع في الجدول التالي :
نضع في بيشر حجما
- ما هي الأدوات الزجاجية المستخدمة في أخذ لازمة من محلول ثنائي اليود ؟ ما هو لون محلول ثنائي اليود؟
- ما هو لون ثيوكبريتات الصوديوم ؟
- إن هذا التفاعل سريع و تام حيث الثنائيتين (Ox/Red) الداخلة في التفاعل هي : ;
- اكتب المعادلة النصفية للأكسدة و الإرجاع .
- أكتب معادلة تفاعل الأكسدة الإرجاعية الحادثة في التفاعل ز ثم المعادلة الإجمالية .
- حدد تفاعل الأكسدة و الإرجاع في هذا التحول مع التعليل
- الأدوات الزجاجية المستخدمة في أخذ لازمة من محلول ثنائي اليود هي ماصةمجهزة بإجاصة. لون محلول ثنائي اليود بني
- لون ثيوكبريتات الصوديوم شفاف .
- المعادلة النصفية للأكسدة :
- المعادلة النصفية للإرجاع :
- معادلة التفاعل الأكسدة الارجاعية :
- المعادلة الإجمالية :
- تفاعل الأكسدة في هذا التحول : لأن شاردةفقدت إلكترونا خلال التحول الكيميائي
تفاعل الإرجاع في هذا التحول :
نسكب تدريجيا محلول ثيوكبريتات الصوديوم على محلول اليود .
لاحظ المتفاعل المحد (Réactif Limitant) هو شاردة
نعتبر
- أكمل جدول تقدم التفاعل التالي :
عند نقطة التكافؤ المتفاعلات تكون كمية مادتها في الجملة الكيميائية بالنسب الستكيومترية في معادلة التفاعل الحادثة في المعايرة . و منه الأفراد المتفاعلة تكون قد تفاعلت كليا .و نقوم بإضافة محلول ثيوكبريتات من السحاحة إلى البيشر .
- نوقف إضافة محلول ثيوكبريتات عندما نلاحظ ظهور لون جديد ثابت .
- ما هو لون المحلول الجديد ؟
- ظهور اللون الجديد على ما يدل ؟
- ما هي هذه الحالة المميزة للتفاعل ؟
و تكون كمية المادة للمتفاعلات موجودة بنسب الأعداد الستكيومترية .
- املآ الجدول الذي يصف الجملة الكيميائية في نقطة التكافؤ
- ما هو عدد مولات اليود المتفاعلة عند نقطة التكافؤ ؟
- استنتج عند نقطة التكافؤ بدلالة
- ما هو عدد مولات شوارد ثيوكبريتات عند نقطة التكافؤ ؟
- استنتج التقدم عند نقطة التكافؤ بدلالة
- استنتج العلاقة عند نقطة التكافؤ . ثم احسبتركيز محلول اليود
- بعد نقطة التكافؤ إذا أضفنا حجما من محلول ثيوكبريتات الصوديوم . ما هو المتفاعل المحد ؟
- نوقف إضافة محلول ثيوكبريتات عندما نلاحظ ظهور لون جديد ثابت .
- لون المحلول الجديد أصفر
- ظهور اللون الجديد يدل على وجود نواتج جديدة .
- الحالة المميزة للتفاعل هي التغير اللوني عند نقطة التكافؤ .
- الجدول :
- عدد مولات اليود المتفاعلة عند نقطة التكافؤ :و منه
- عند نقطة التكافؤ بدلالة:وو منه
- عدد مولات شوارد ثيوكبريتات عند نقطة التكافؤ هي :
- استنتاج التقدم عند نقطة التكافؤ بدلالة:و منه
- استنتاج العلاقة عند نقطة التكافؤ :وو منهو منه
حساب
- بعد نقطة التكافؤ إذا أضفنا حجما من محلول ثيوكبريتات الصوديوم . المتفاعل المحد هو :
- لون محلول ثيوكبريتات الصوديوم في السحاحة شفاف و لون محلول اليود في البيشر بني و بعد إضافة محلول ثيوكبريتات الصوديوم غلى اليود يبدأ اللون البني يتلاشى بعد إضافة حجم مناسب يظهر لون أصفر في الخليط الموجود في البيشر و لا يزول بالتحريك نقول في هذه الحالة أننا بلغنا نقطة التكافؤ و تكون كمية المادة للمتفاعلات موجودة بنسب الاعداد الستكيومترية .
-
قبل نقطة التكافؤ المتفاعل المحد هو المتفاعل ثيوكبريتات أي المعايرة ، و بعد نقطة التكافؤ ، المتفاعل المحد (Limitant) هو المتفاعل المعاير الموجود في محلول اليود .
إذا حدث تفاعل تام بين متفاعلين
يكون عند نقطة التكافؤ :
يمكن تحقيق المعايرة عن طريق المحاكاة بواسطة برمجية خاصة (logiciel approprié)
- شغل البرنامج (Excel) ثم افتح الملف (dosage 2AS)
- اختار "الشاشة كاملة" (plein écran) , في الخانة " اختبار التفاعل " اختار ( الحمض و الأساس ) أو ( المؤكسد و المرجع ) مثلا " ثنائي اليود بواسطة ثيوكبريتات الصوديوم "
- اختار في السحاحة محلول ثيوكبريتات الصوديوم تركيزه المولي معلوم (مثلا) أختر في البيشر حجما, ( مثلا) من محلول ثنائي اليود تركيزه المولي
- أنقر (Afficher) من متابعة تطور كميات المادة
- أنقر على (Dosage automatique) من أجل متابعة كميات المادة خلال عملية المعايرة كلها .
يقدم للتلاميذ مصل فيزيولوجي (Sérum physioloqique)
- يطلب منهم قراءة وتحليل البطاقة التي يحملها المصل .
- نريد التأكد من التركيز المولي لكلور الصوديوم في المصل عن طريق قياس الناقلية؟ هل هذه الطريقة ممكنة ؟ برر إجابتك .
- أحد التلاميذ الذي أجاب يقترح تمديد المصل 20 مرة حتى يصبح تركيزه المولى
- اقترح طريقة تمكن من ذلك . علما أن يوجد في المخبر محلولا من كلور الصوديوم تركيزه المولي كيف يمكن معرفةثم؟ هل هذه النتيجة تتوافق مع المعلومات التي تحملها البطاقة ؟









